
-

生物通官微
陪你抓住生命科技
跳动的脉搏
跨祖先头颈癌全基因组关联研究揭示29个新风险位点与基因-环境交互作用
【字体: 大 中 小 】 时间:2025年10月04日 来源:Nature Communications 15.7
编辑推荐:
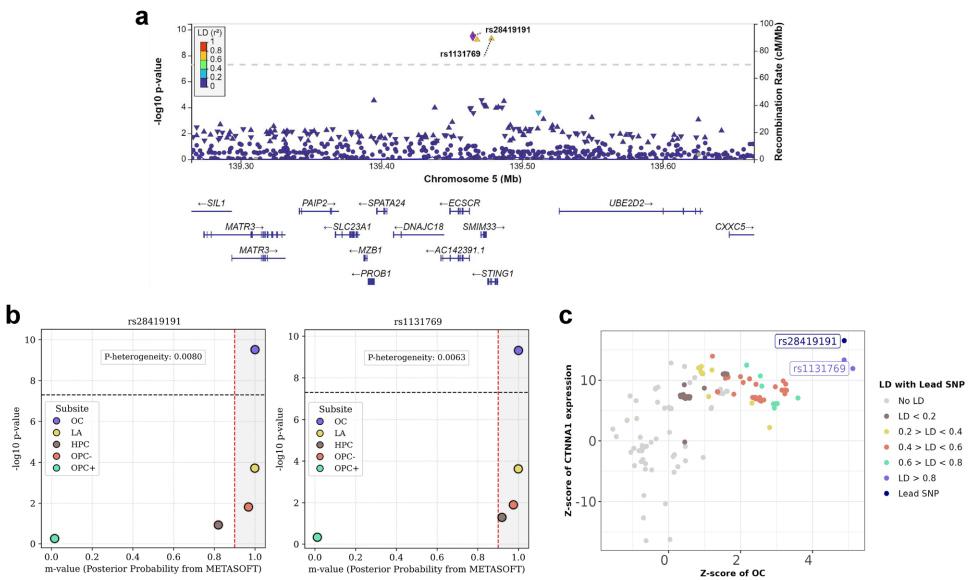
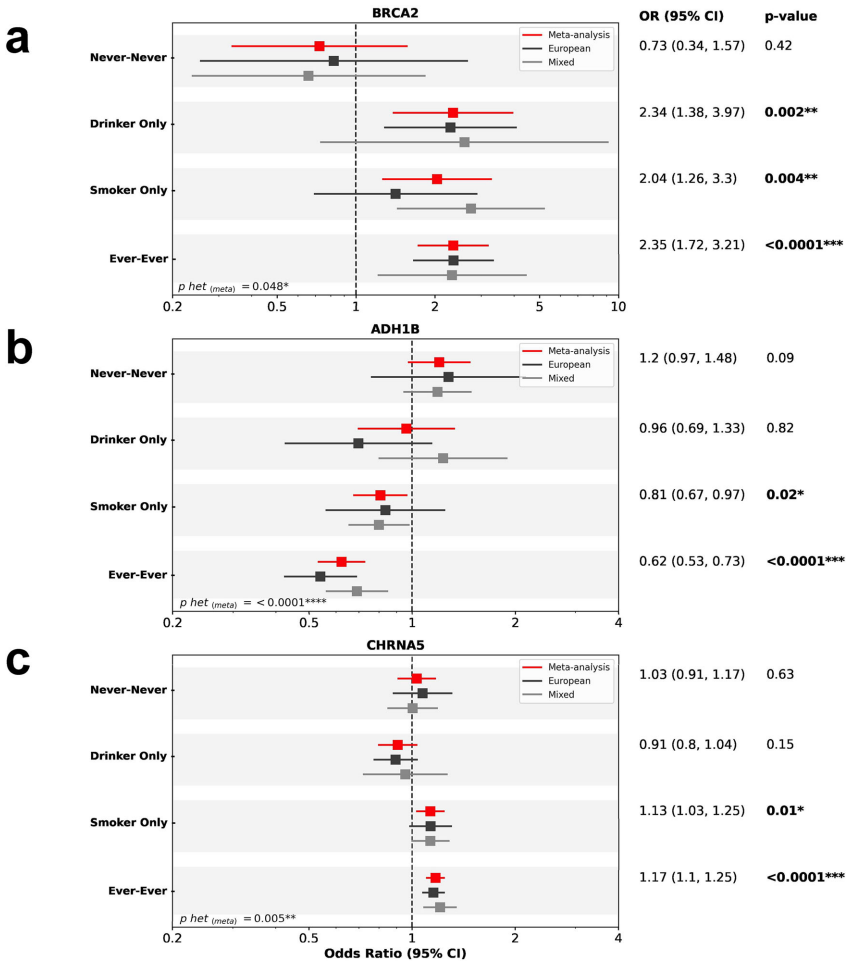
本研究通过跨祖先GWAS和HLA精细定位,针对19,000例头颈鳞癌(HNSCC)患者开展多维度遗传分析,发现18个新型基因组风险位点和11个HLA区域信号,首次揭示TP53 3'UTR变异rs78378222可降低40%总体风险,并验证BRCA2、ADH1B等基因与环境因素(吸烟、饮酒)的交互作用,为HNSCC精准预防和分子分型提供重要依据。

 生物通微信公众号
生物通微信公众号
知名企业招聘