
-

生物通官微
陪你抓住生命科技
跳动的脉搏
结直肠癌中脂肪-肿瘤交互作用:(表观)遗传生物标志物鉴定揭示肿瘤进展与恶病质新机制
【字体: 大 中 小 】 时间:2025年10月07日 来源:Cell Death & Disease 9.6
编辑推荐:
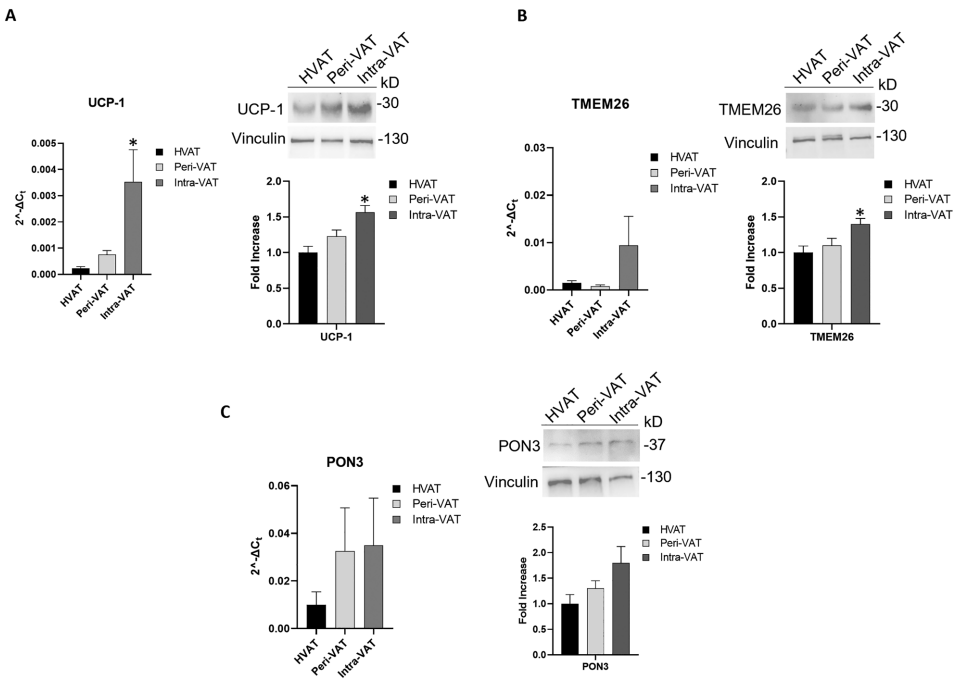
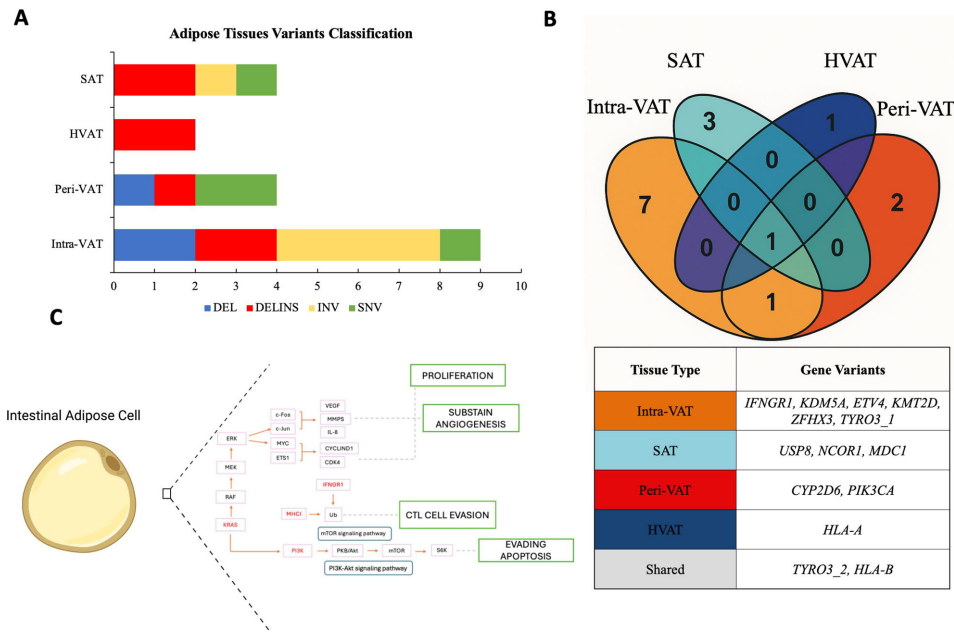
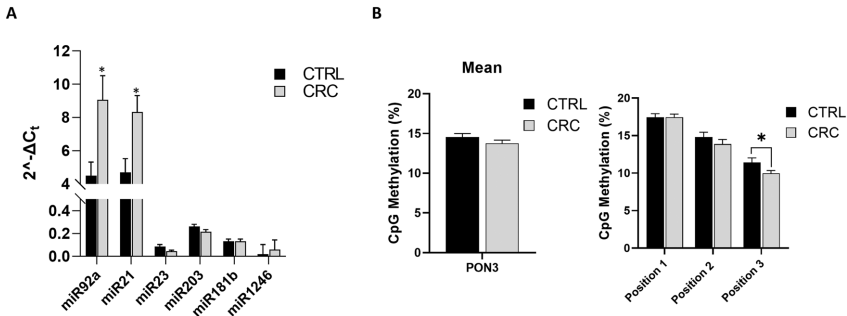
本刊推荐:为解决肥胖相关结直肠癌(CRC)进展及癌症恶病质(CAC)机制不明的问题,研究人员开展了脂肪组织(AT)与CRC分子交互作用研究。通过全基因组测序(WGS)和表观遗传分析,发现近肿瘤脂肪(Intra-VAT)存在代谢重编程(UCP-1+、TMEM26+)、纤维化(TGF-β+、胶原+)和致癌突变(KRAS、HLA、MET)。循环miR-92a与体脂率正相关,与瘦体质量负相关。PON3基因甲基化与营养状况相关,为CRC治疗提供了新靶点和生物标志物。





 生物通微信公众号
生物通微信公众号
知名企业招聘