
-

生物通官微
陪你抓住生命科技
跳动的脉搏
靶向ROR2的CAR-T细胞疗法:治疗血液瘤与实体瘤的新希望,安全有效
【字体: 大 中 小 】 时间:2025年10月07日 来源:Cell Reports Medicine 10.6
编辑推荐:
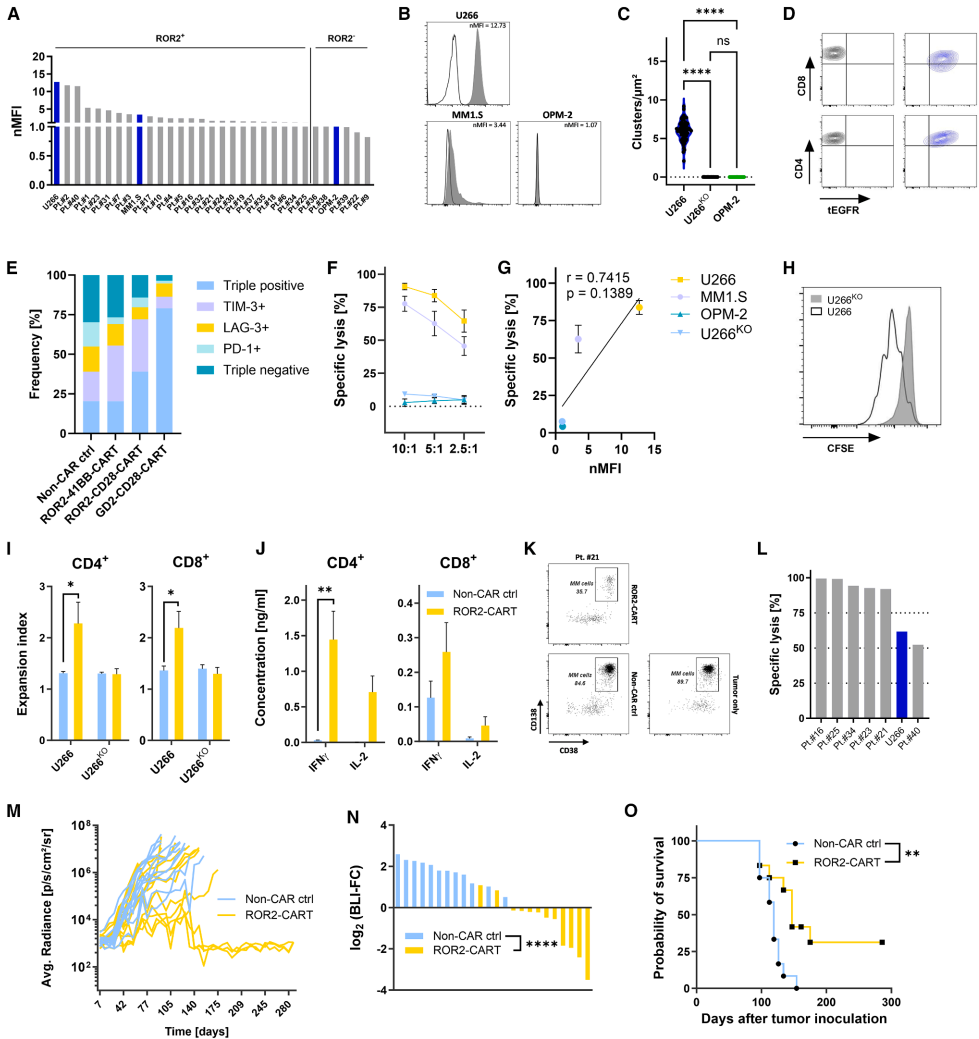
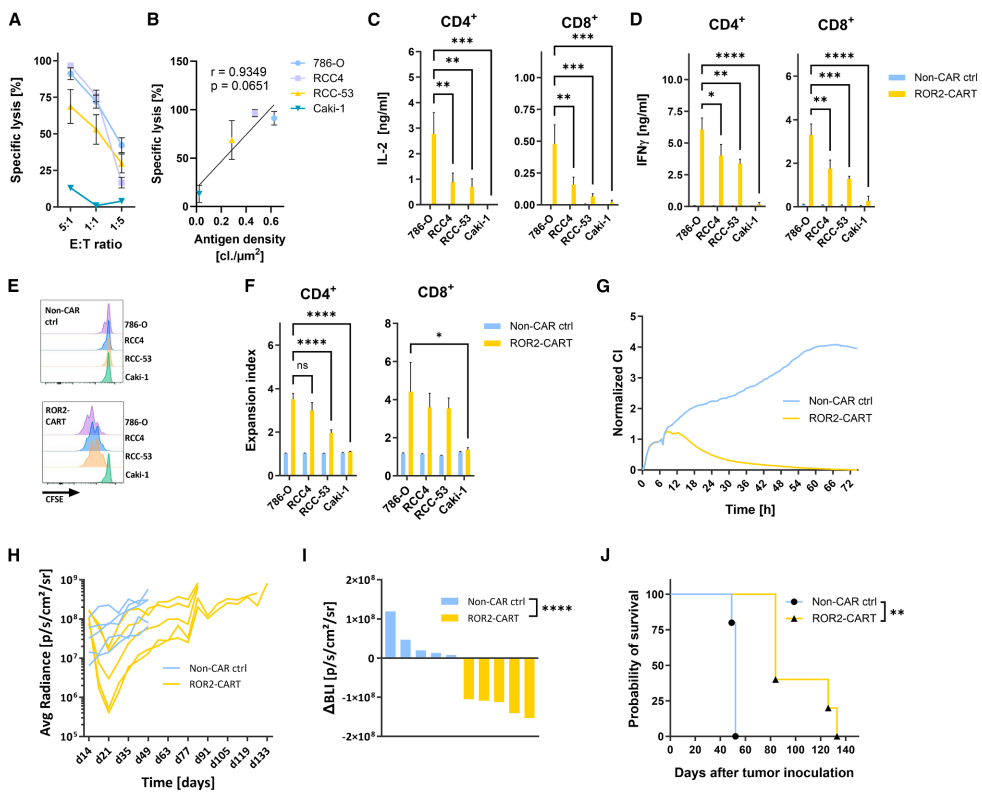
本期推荐:为解决多发性骨髓瘤(MM)和透明细胞肾细胞癌(ccRCC)缺乏有效靶向治疗的难题,研究人员开展针对受体酪氨酸激酶样孤儿受体2(ROR2)的CAR-T细胞疗法研究。结果表明,ROR2-CAR T细胞在体外和体内模型中均表现出强大的抗肿瘤活性,且在小鼠中耐受良好,无脱靶毒性。该研究为ROR2作为CAR-T治疗新靶点提供了坚实证据,有望应用于多种ROR2阳性肿瘤的治疗。
 生物通微信公众号
生物通微信公众号
知名企业招聘