
-

生物通官微
陪你抓住生命科技
跳动的脉搏
基于机器学习的HBV相关代偿性晚期慢性肝病患者肝细胞癌风险预测模型构建与验证
【字体: 大 中 小 】 时间:2025年10月08日 来源:Journal of Cancer Research and Clinical Oncology 2.8
编辑推荐:
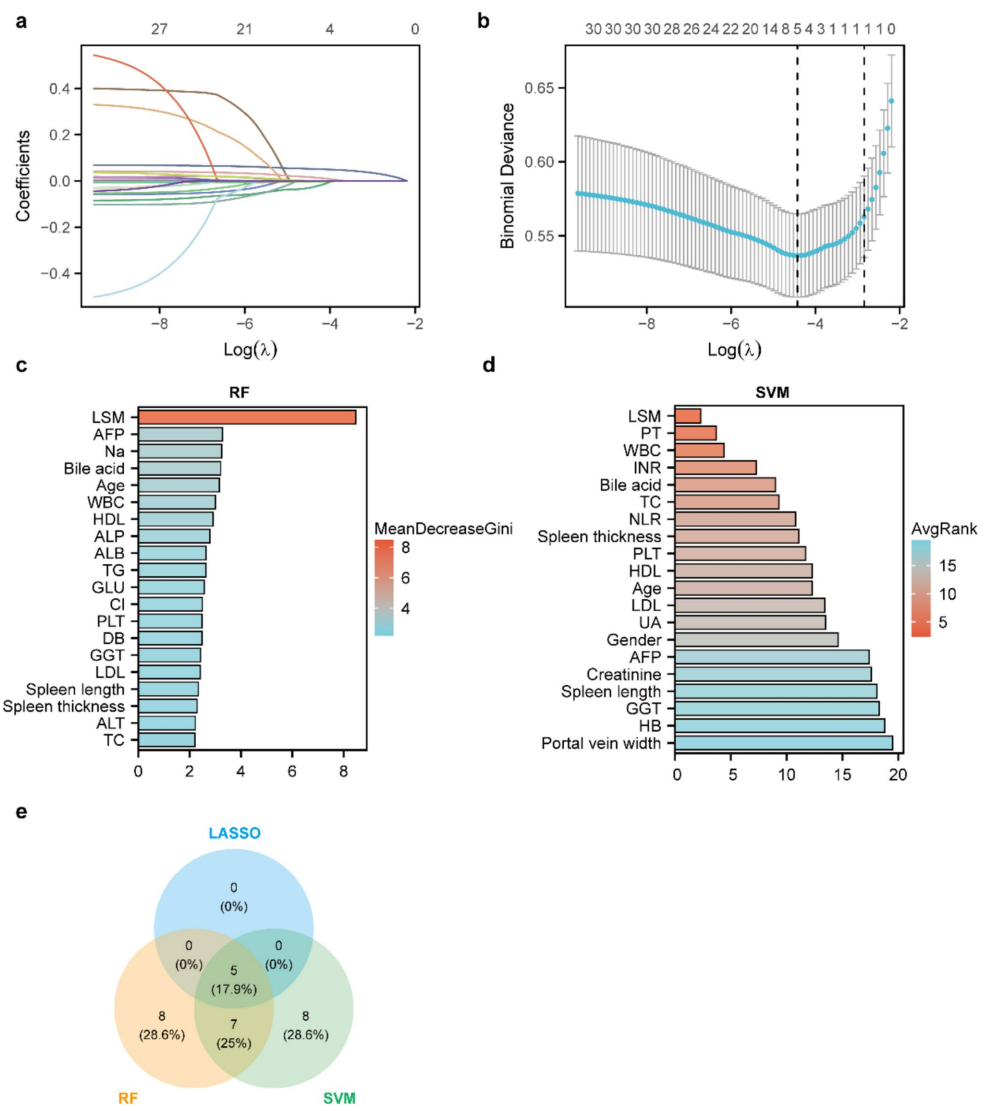
本研究针对HBV相关代偿性晚期慢性肝病(cACLD)患者肝细胞癌(HCC)风险预测需求,通过机器学习算法构建了高性能预测模型。研究团队利用LASSO回归、随机森林(RF)和支持向量机(SVM)进行特征筛选,最终确定肝脏硬度测量(LSM)、年龄、血小板(PLT)、胆汁酸和白细胞计数(WBC)五个关键预测因子。其中RF模型表现最优,在验证队列中曲线下面积(AUC)达0.956,灵敏度为0.808。SHAP可解释性分析揭示LSM是最重要预测因子(平均SHAP值1.2),并发现LSM与PLT、胆汁酸间存在显著协同效应。该模型为cACLD患者的HCC风险分层管理提供了重要工具。



 生物通微信公众号
生物通微信公众号
知名企业招聘