
-

生物通官微
陪你抓住生命科技
跳动的脉搏
线粒体重构与细胞骨架动态调控:揭示DLBCL抗体诱导补体依赖性细胞毒性的细胞内耐药新机制
【字体: 大 中 小 】 时间:2025年10月08日 来源:Blood Cancer Journal 11.6
编辑推荐:
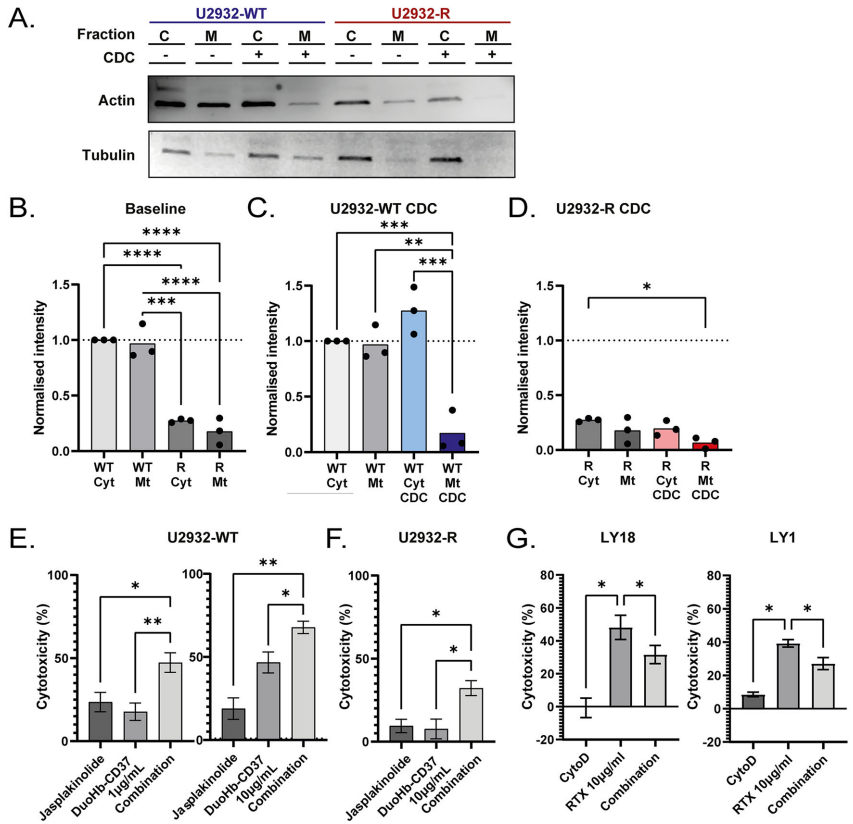
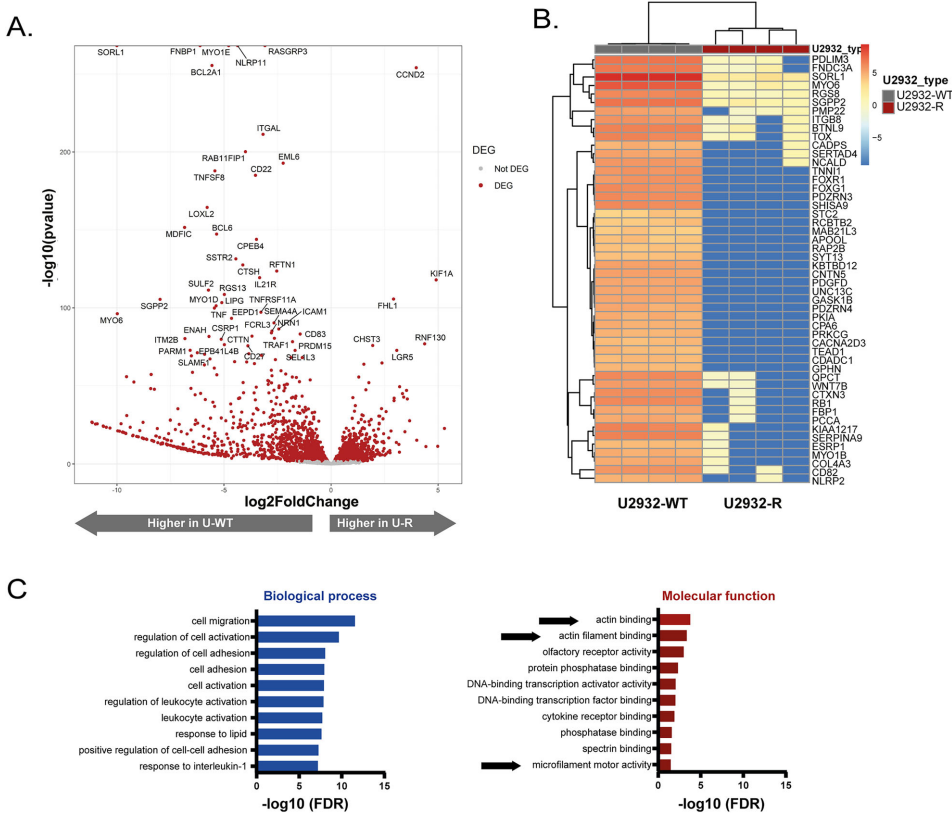
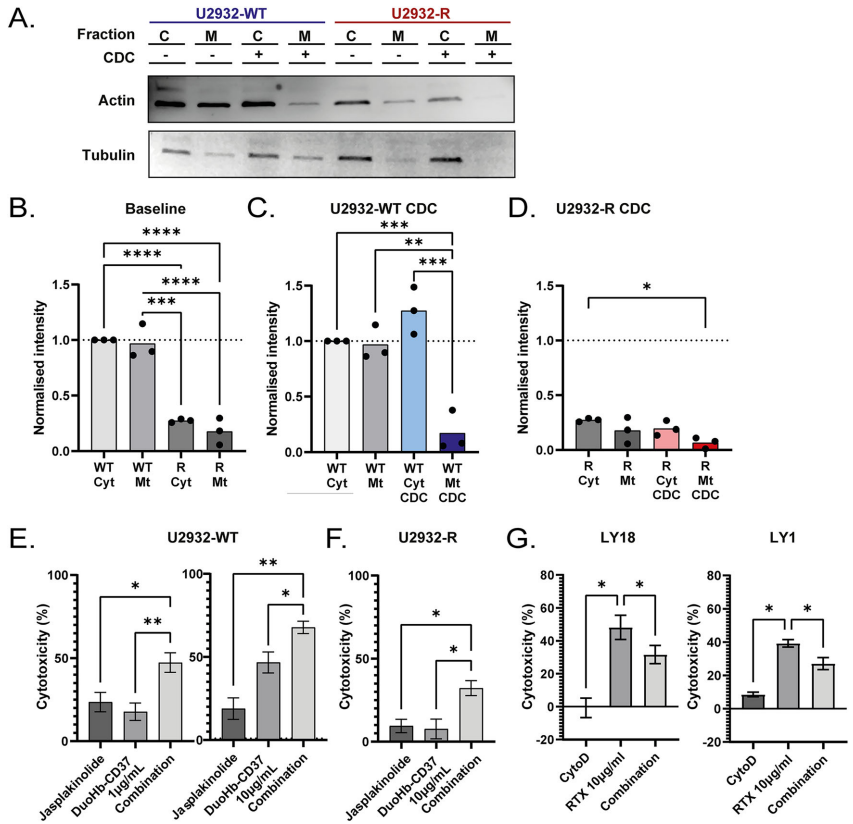
本刊推荐:为解决弥漫性大B细胞淋巴瘤(DLBCL)对抗体诱导补体依赖性 cytotoxicity(CDC)的耐药机制问题,荷兰研究团队通过CRISPR-Cas9筛选和转录组分析,发现线粒体损伤与ROS爆发是CDC核心杀伤机制,耐药细胞通过下调肌动蛋白(actin)相关基因表达、减少线粒体分裂和线粒体自噬(mitophagy)、促进线粒体融合来实现免疫逃逸。临床样本验证细胞骨架动态与抗体疗效正相关,为克服R-CHOP方案耐药提供新靶点。

 生物通微信公众号
生物通微信公众号
知名企业招聘