
-

生物通官微
陪你抓住生命科技
跳动的脉搏
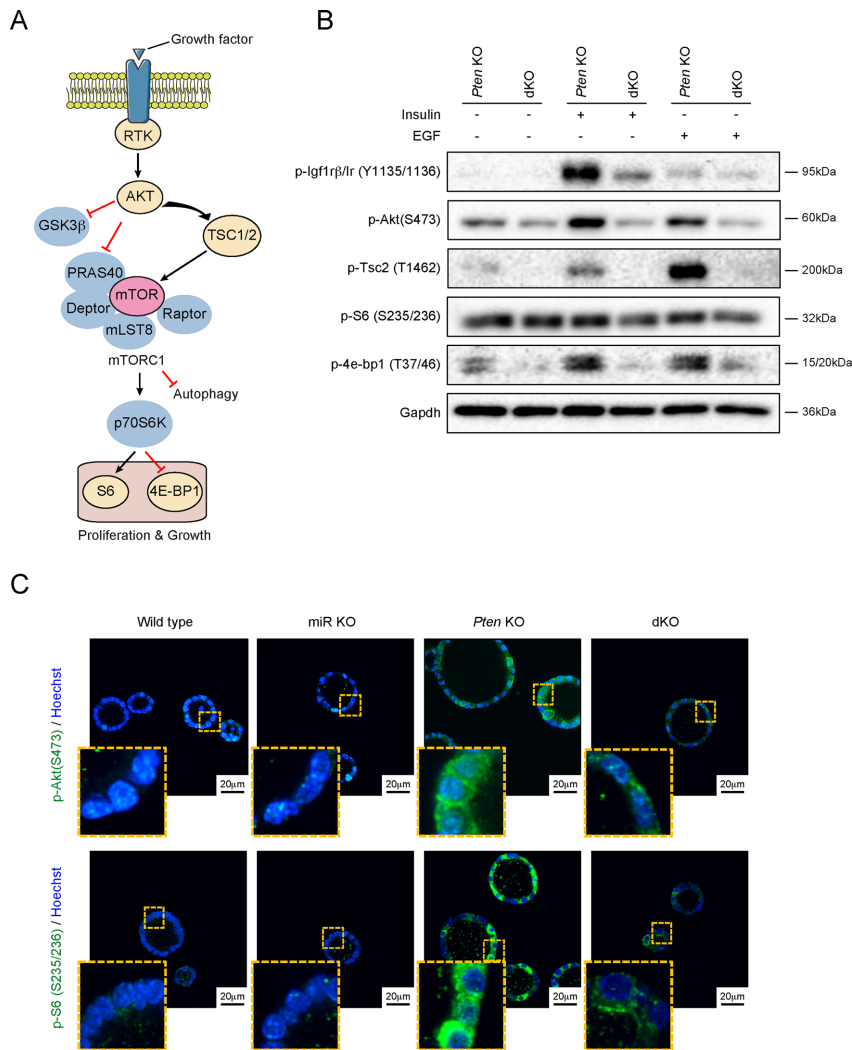
PTEN缺失驱动的子宫内膜癌进展依赖于miR-424(322)~503簇的调控作用
【字体: 大 中 小 】 时间:2025年10月08日 来源:Cell Death & Disease 9.6
编辑推荐:
本研究针对PTEN缺失导致子宫内膜癌(EC)中PI3K/AKT信号异常激活及TGFβ介导凋亡抵抗的机制,通过构建双基因敲除小鼠模型,首次揭示miR-424(322)~503簇在PTEN缺失背景下通过调控胰岛素/IGF-1信号通路和PI3K/AKT信号传导,促进子宫内膜细胞增殖并抑制TGFβ诱导的凋亡。该发现为PTEN驱动型子宫内膜癌提供了新的治疗靶点,具有重要临床转化价值。




 生物通微信公众号
生物通微信公众号
知名企业招聘