
-

生物通官微
陪你抓住生命科技
跳动的脉搏
酒精暴露显著影响下丘脑基因表达,揭示与GnRH信号传导和甲状腺激素生成的复杂联系
【字体: 大 中 小 】 时间:2025年10月09日 来源:BMC Medical Genomics 2
编辑推荐:
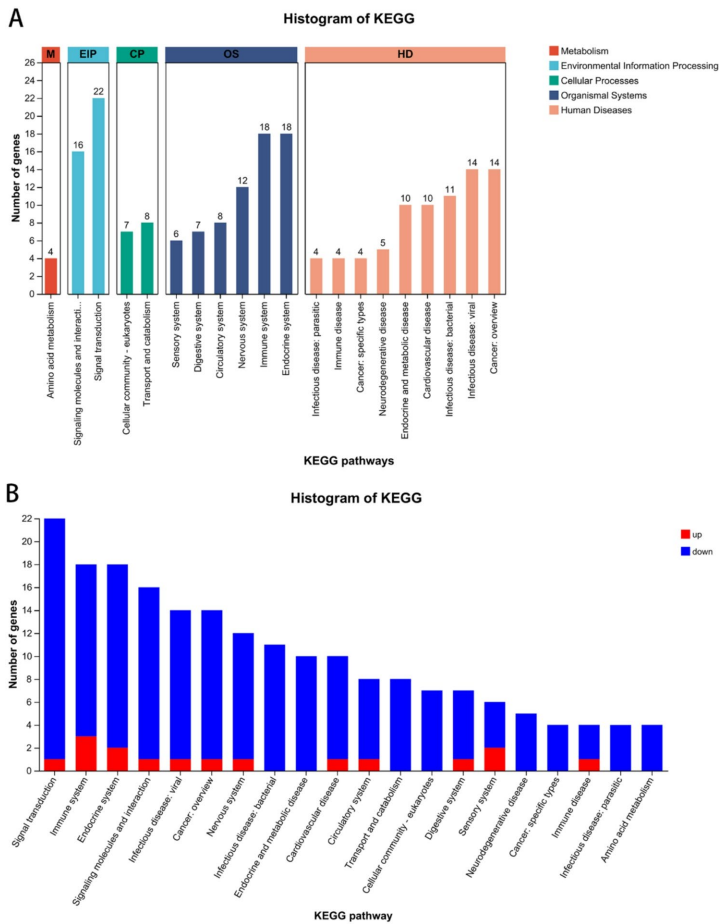
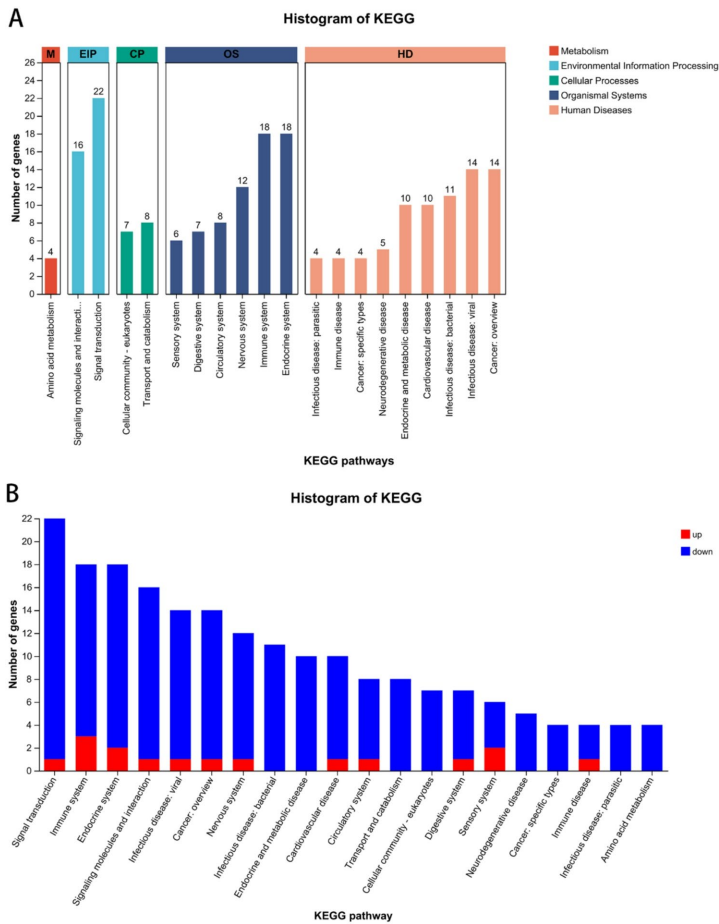
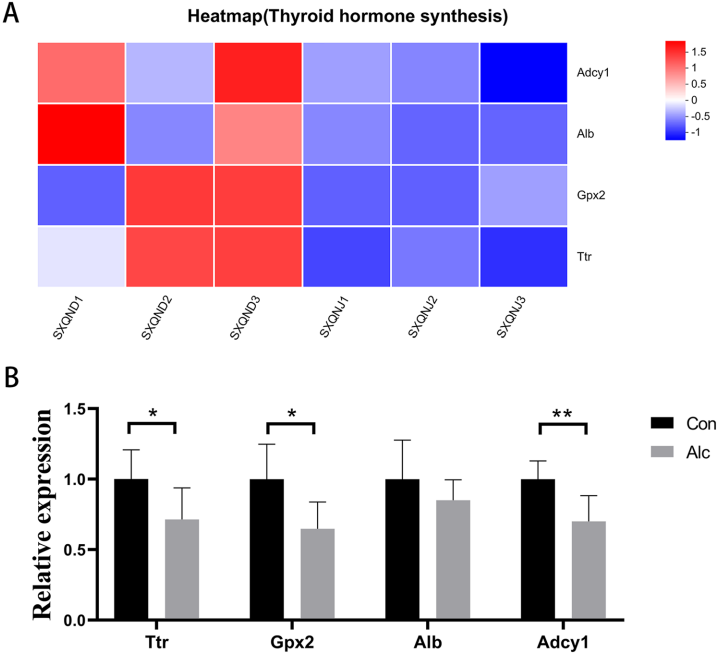
本研究探讨了酒精暴露对小鼠下丘脑基因表达的影响及其在酒精使用障碍(AUD)发病机制中的作用。通过转录组测序和生物信息学分析,研究人员发现酒精暴露显著调控了下丘脑中与发育过程、GnRH信号通路及甲状腺激素合成通路相关的基因表达。研究验证了Prkcd、Ptk2b、Adcy1、Gpx2和Ttr等关键基因的表达下调,揭示了酒精可能通过影响神经内分泌通路参与AUD的病理过程,为深入理解AUD的分子机制提供了新视角。




 生物通微信公众号
生物通微信公众号
知名企业招聘