
-

生物通官微
陪你抓住生命科技
跳动的脉搏
miR-140-3p通过调控轴突运动蛋白KIF5A介导脊髓性肌萎缩症轴突运输退化机制研究
【字体: 大 中 小 】 时间:2025年10月09日 来源:Cell Death Discovery 7
编辑推荐:
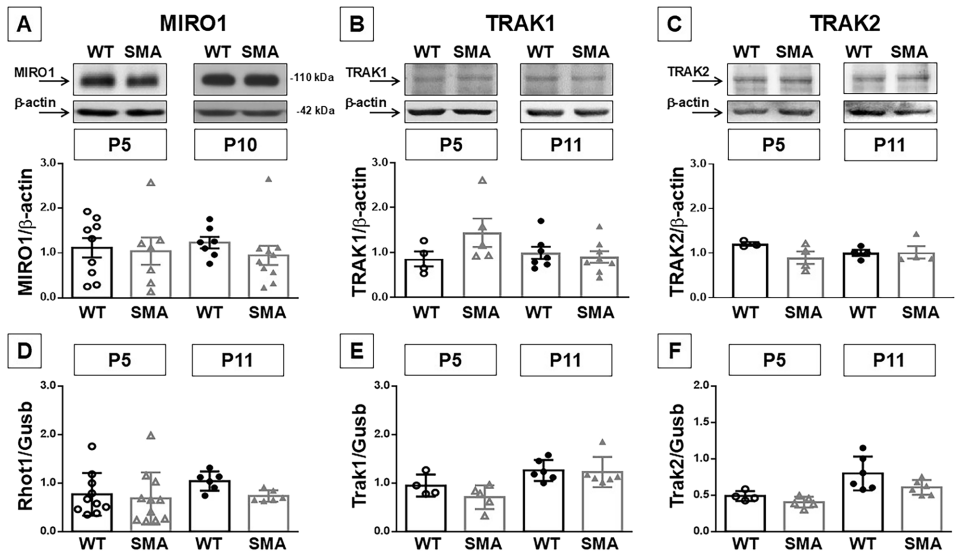
本研究针对脊髓性肌萎缩症(SMA)中运动神经元选择性退化的分子机制未阐明问题,开展了KIF5A轴突运输调控机制研究。发现KIF5A在SMA小鼠脊髓中特异性下调,miR-140-3p通过靶向KIF5A 3'UTR负向调控其表达,使用AntimiR-140-3p干预可改善运动行为表现。该研究揭示了轴突运输障碍在SMA中的关键作用,为开发新型治疗策略提供了靶点。




 生物通微信公众号
生物通微信公众号
知名企业招聘