
-

生物通官微
陪你抓住生命科技
跳动的脉搏
分子模拟揭示MS2噬菌体成熟蛋白动态行为及其在病毒侵染中的关键作用
【字体: 大 中 小 】 时间:2025年10月09日 来源:Scientific Reports 3.9
编辑推荐:
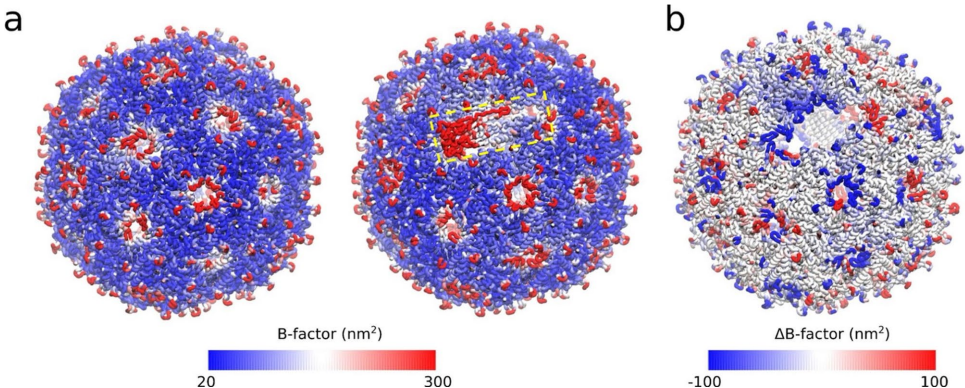
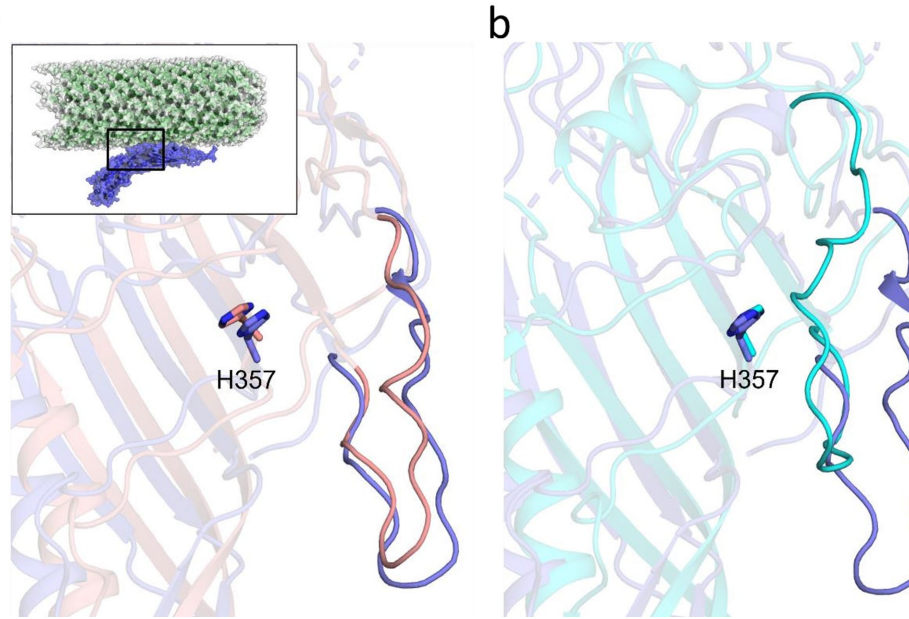
本研究通过0.5微秒全原子分子动力学模拟,揭示了MS2噬菌体成熟蛋白(MP)的高动态特性及其与衣壳稳定性和宿主受体结合的分子机制。研究发现MP的"尖端"和"侧环"区域具有显著柔性,可能通过构象选择机制促进与F菌毛受体的结合,同时MP的存在增强了衣壳盐桥相互作用稳定性,为开发靶向病毒-宿主相互作用的抗病毒策略提供了新见解。


 生物通微信公众号
生物通微信公众号
知名企业招聘