
-

生物通官微
陪你抓住生命科技
跳动的脉搏
爱沙尼亚生物样本库揭示BMI新遗传位点:ADGRL3基因的首次关联及POMC/PTPRT罕见变异的功能机制
【字体: 大 中 小 】 时间:2025年10月09日 来源:Nature Communications 15.7
编辑推荐:
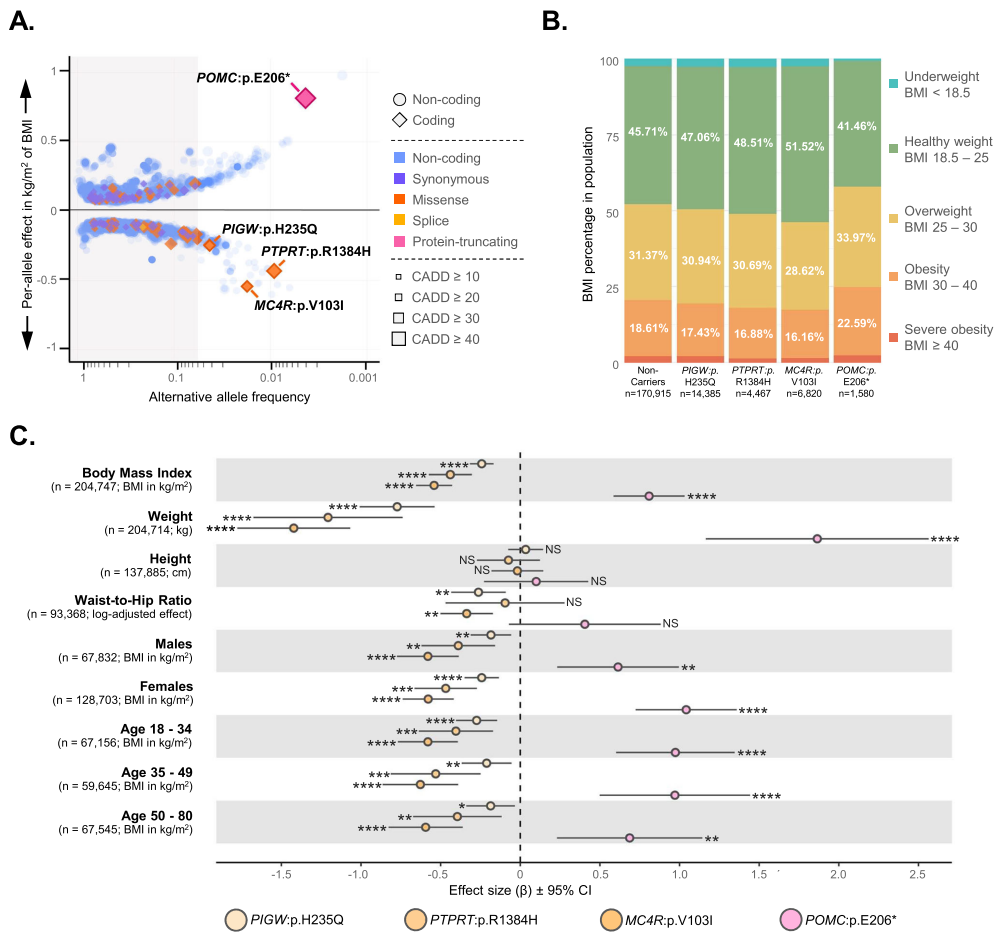
为解决肥胖遗传机制在特定人群中的未解之谜,研究人员利用爱沙尼亚生物样本库(n=204,747)开展BMI全基因组关联研究(GWAS),发现214个显著位点,包括首次与BMI关联的ADGRL3基因常见变异(-0.18 kg/m2;P=3.21×10-9),以及影响瘦素-黑皮质素通路的罕见错义变异PTPRT:p.Arg1384His(降低BMI)和蛋白质截短变异POMC:p.Glu206*(升高BMI)。该研究为肥胖干预提供了新靶点,凸显人群特异性生物样本库在发现高影响遗传变异中的价值。






 生物通微信公众号
生物通微信公众号
知名企业招聘