
-

生物通官微
陪你抓住生命科技
跳动的脉搏
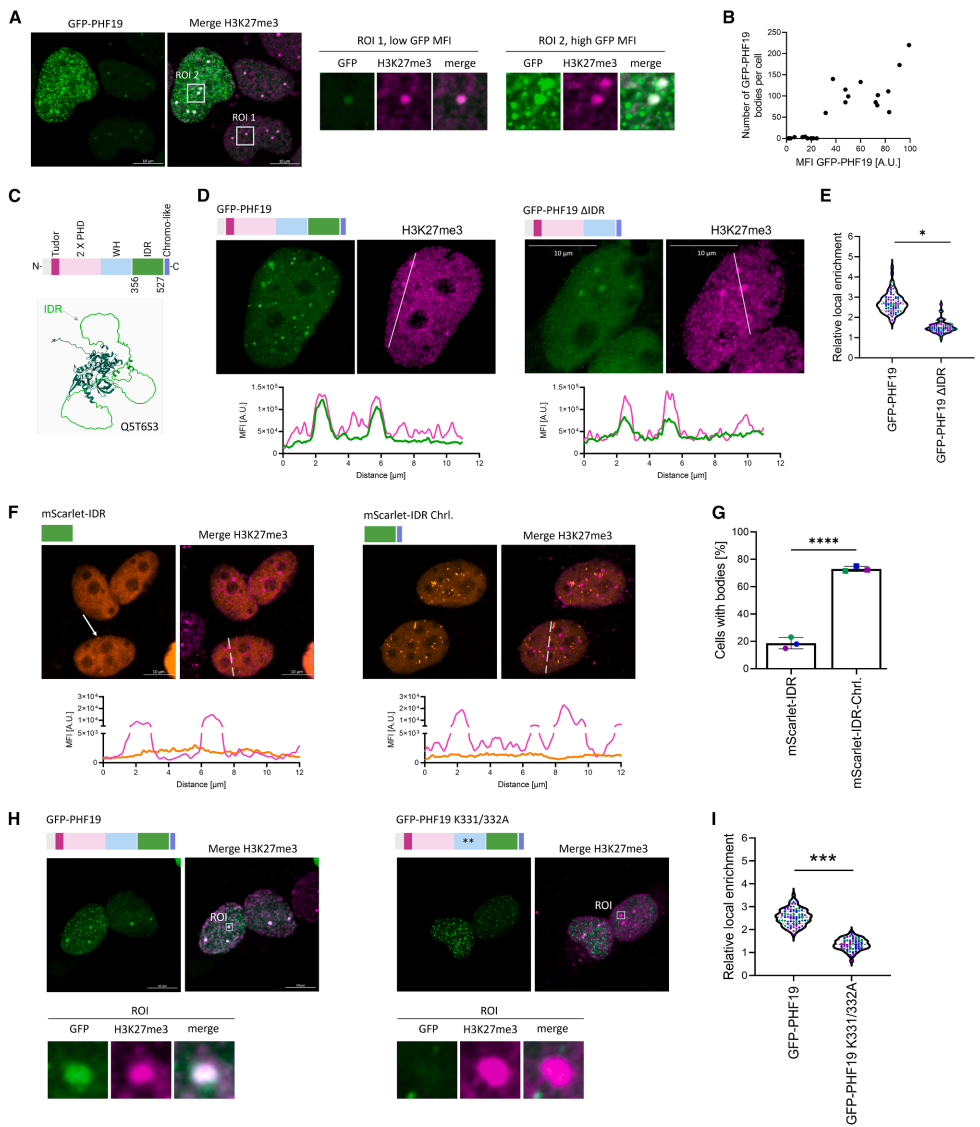
PHF19通过驱动PRC2核内簇增强三阴性乳腺癌细胞运动性的机制研究
【字体: 大 中 小 】 时间:2025年10月09日 来源:Cell Reports 6.9
编辑推荐:
本研究针对三阴性乳腺癌(TNBC)中PRC2亚核空间组织调控机制不明的问题,通过整合原位光蛋白组学、高分辨率成像和功能基因组学技术,发现PHF19通过其内在无序区(IDR)介导PRC2形成微米级核内簇,重塑H3K27me3宏结构域并促进TNBC细胞运动性,揭示了PRC2空间调控的非酶活功能层面对癌症细胞行为的直接影响。


 生物通微信公众号
生物通微信公众号
知名企业招聘