
-

生物通官微
陪你抓住生命科技
跳动的脉搏
综述:ING5——超越肿瘤抑制在细胞生理学与疾病中的多维作用
【字体: 大 中 小 】 时间:2025年10月10日 来源:Epigenetics & Chromatin 3.5
编辑推荐:
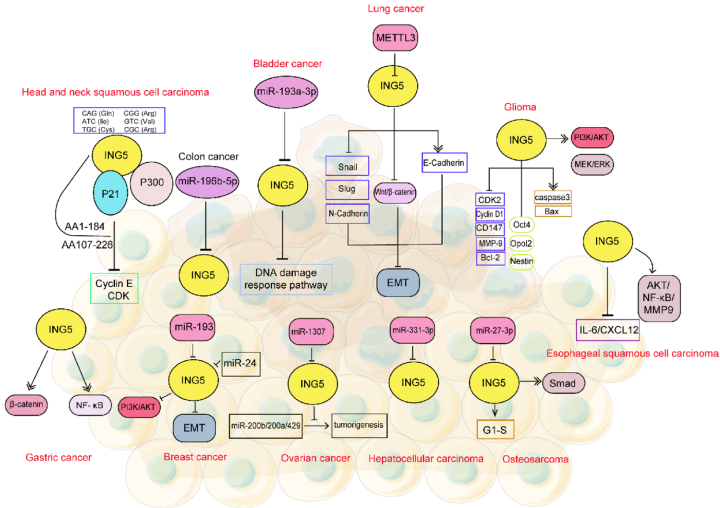
本综述深入探讨了表观遗传调控因子ING5的多维功能,超越其经典肿瘤抑制角色。文章系统解析了ING5在染色质调控、DNA复制、细胞周期等核心生物学过程(如PI3K/Akt、p53通路)中的机制,并揭示其在干细胞分化、心脏发育(如LRP6-ING5-p21轴)、代谢调节(如SCFJFK-ING5-AMPK通路)和血管功能中的新颖作用。ING5通过组蛋白修饰(如H3K4me3识别、H3K23ac调控)和复合物互作(如MOZ/MORF、HBO1、Set1A/COMPASS)发挥功能,是癌症治疗(如靶向核质转运、联合KAT6A抑制剂)和发育疾病研究的潜在靶点。


 生物通微信公众号
生物通微信公众号
知名企业招聘