
-

生物通官微
陪你抓住生命科技
跳动的脉搏
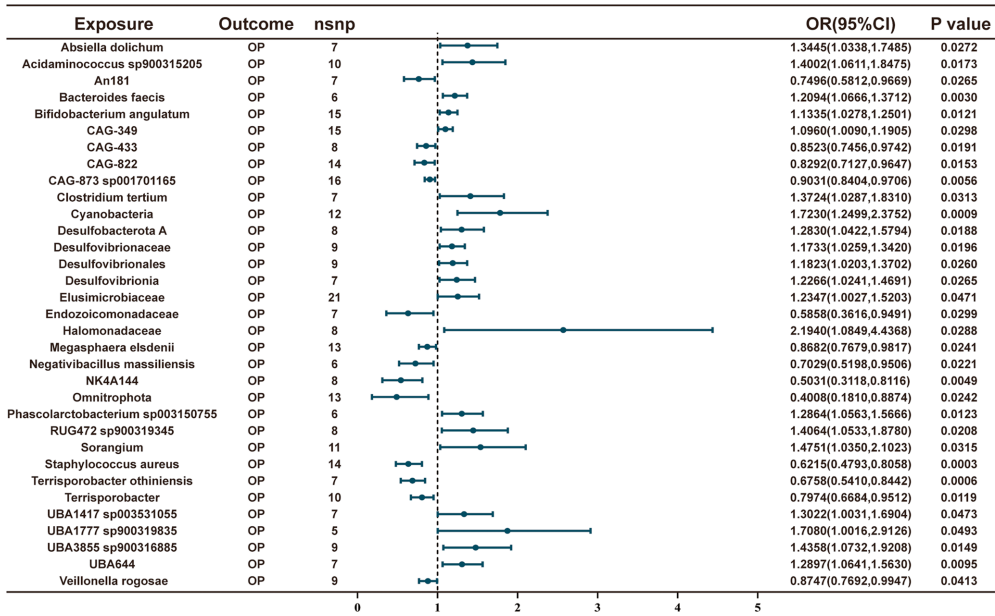
肠道菌群通过调控铁死亡相关蛋白MDM4防治骨质疏松症的新机制:一项孟德尔随机化研究
【字体: 大 中 小 】 时间:2025年10月10日 来源:World Journal of Microbiology and Biotechnology 4
编辑推荐:
本研究针对骨质疏松症(OP)防治难题,通过孟德尔随机化(MR)分析揭示了肠道菌群通过铁死亡(ferroptosis)通路调控OP的因果机制。研究发现Terrisporobacter othiniensis菌通过上调铁死亡调控蛋白MDM4表达,介导6.8%的骨保护效应,为“肠-骨轴”理论提供了遗传学证据,为OP防治提供了微生物-铁死亡靶向新策略。


 生物通微信公众号
生物通微信公众号
知名企业招聘