
-

生物通官微
陪你抓住生命科技
跳动的脉搏
基于转录组的儿童急性髓系白血病分子分型与预后分层新策略
【字体: 大 中 小 】 时间:2025年10月10日 来源:Annals of Hematology 2.4
编辑推荐:
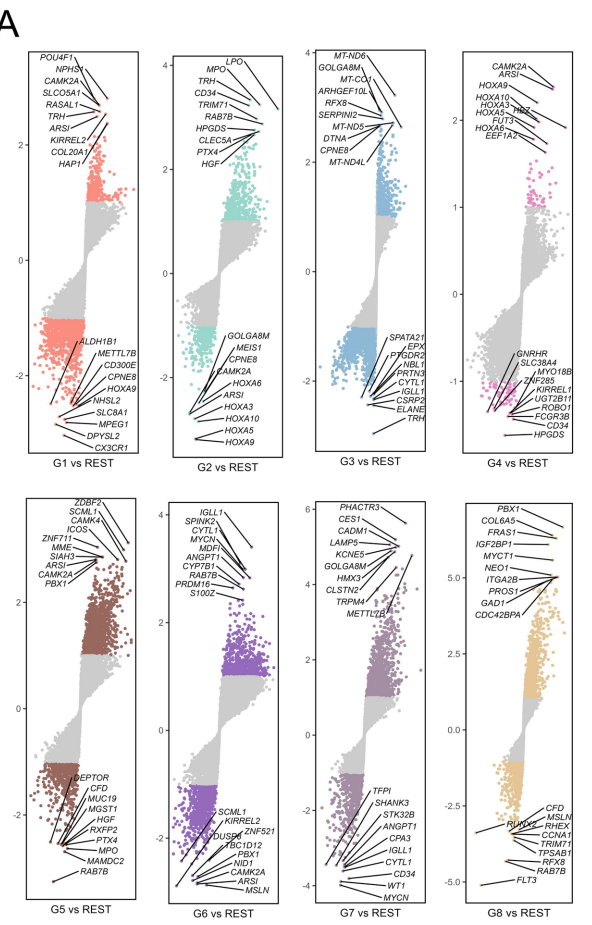
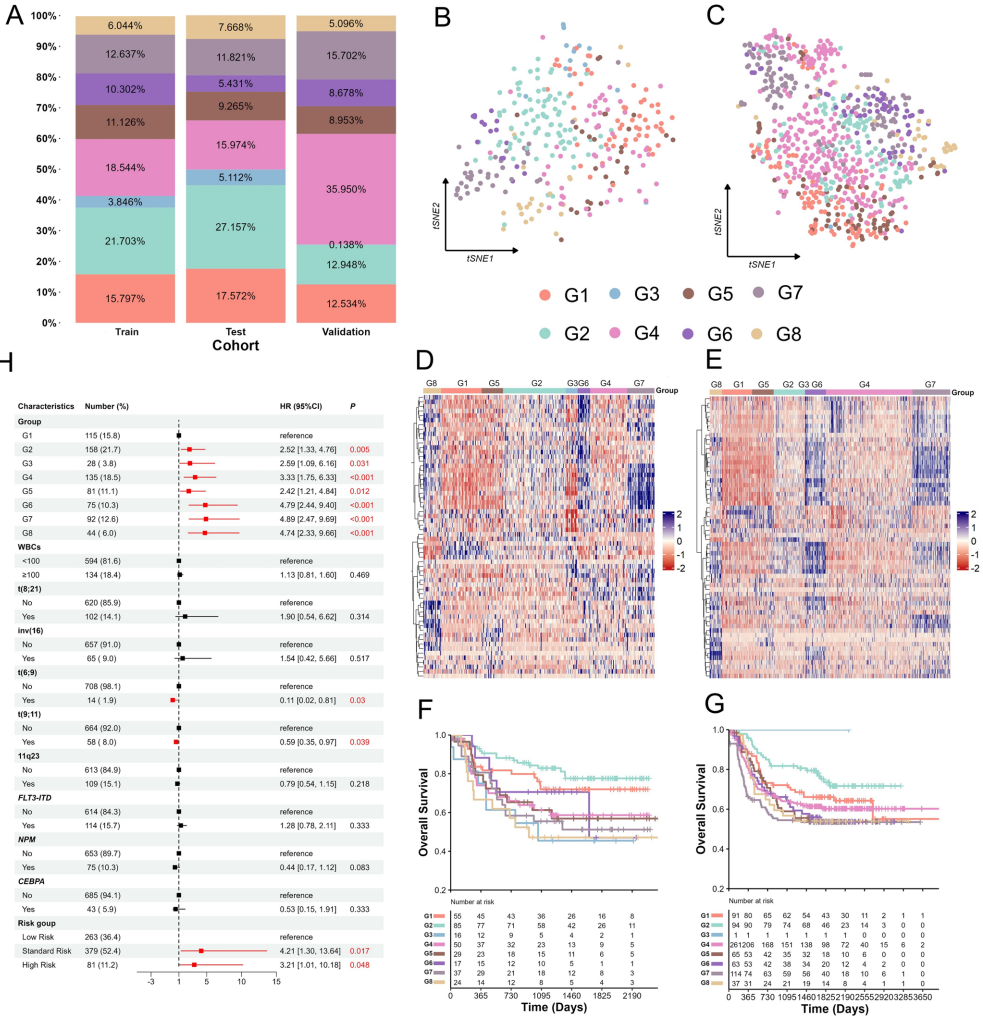
本研究针对儿童急性髓系白血病(AML)存在的生物学异质性和生存差异问题,通过整合公共数据集转录组数据,利用机器学习算法开发了新的预后预测模型。研究人员首次将AML重新分为8个分子亚型,发现各亚型在基因表达、免疫微环境、信号通路等方面存在显著差异,并鉴定出HSD17B10、NDUFS8等5个关键预后基因。XGBoost模型在预测中表现最佳(AUC=0.999),该研究为AML的精准分型和个体化治疗提供了新思路。





 生物通微信公众号
生物通微信公众号
知名企业招聘