
-

生物通官微
陪你抓住生命科技
跳动的脉搏
FLT3基因内含子串联重复中插入外源序列与急性髓系白血病不良预后显著相关:一项揭示分子异质性的临床研究
【字体: 大 中 小 】 时间:2025年10月10日 来源:Annals of Hematology 2.4
编辑推荐:
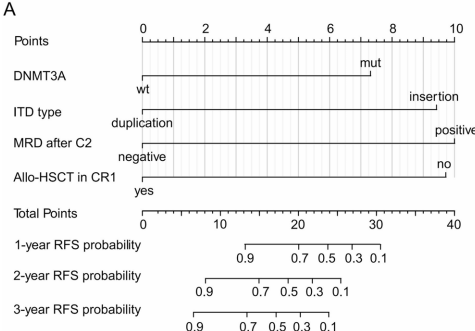
本研究针对FLT3-ITD阳性急性髓系白血病(AML)患者,深入探讨了携带外源序列的ITD突变类型对诱导治疗反应及长期预后的影响。研究发现,插入型ITD(占45.97%)患者复合完全缓解率(CRc)和流式微小残留病(MFC-MRD)阴性率显著降低,且2年无复发生存(RFS)和总生存(OS)更差。通过构建列线图模型,提出了基于ITD类型的新型预后分层策略,为FLT3-ITD阳性AML的精准治疗提供重要依据。




 生物通微信公众号
生物通微信公众号
知名企业招聘