
-

生物通官微
陪你抓住生命科技
跳动的脉搏
STK11缺失通过CXCL1介导的PMN-MDSCs扩增重塑乳腺癌免疫微环境
【字体: 大 中 小 】 时间:2025年10月10日 来源:Cancer Immunology, Immunotherapy 4.6
编辑推荐:
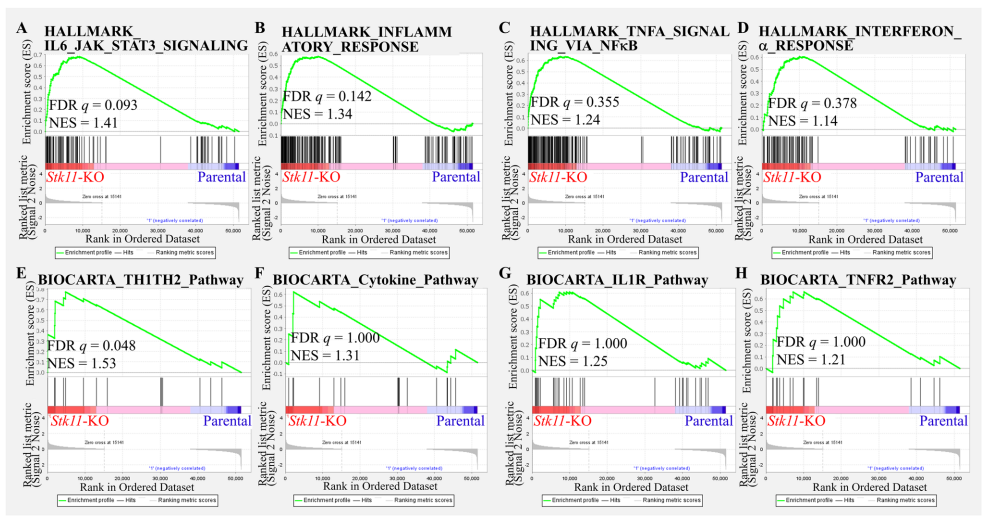
本研究针对乳腺癌免疫抑制微环境中STK11基因的调控机制展开探索。研究人员通过构建Stk11基因敲除小鼠模型,结合RNA测序与细胞因子阵列技术,发现STK11缺失会激活免疫相关信号通路并显著上调CXCL1表达。体内实验证实Stk11-KO肿瘤具有更强致瘤性,并伴随 polymorphonuclear myeloid-derived suppressive cells(PMN-MDSCs)的扩增。该研究为STK11缺陷型乳腺癌患者提供了靶向免疫抑制微环境的新治疗策略。


 生物通微信公众号
生物通微信公众号
知名企业招聘