
-

生物通官微
陪你抓住生命科技
跳动的脉搏
界面张力与生长共同驱动机械性细胞竞争
【字体: 大 中 小 】 时间:2025年10月10日 来源:Current Biology 7.5
编辑推荐:
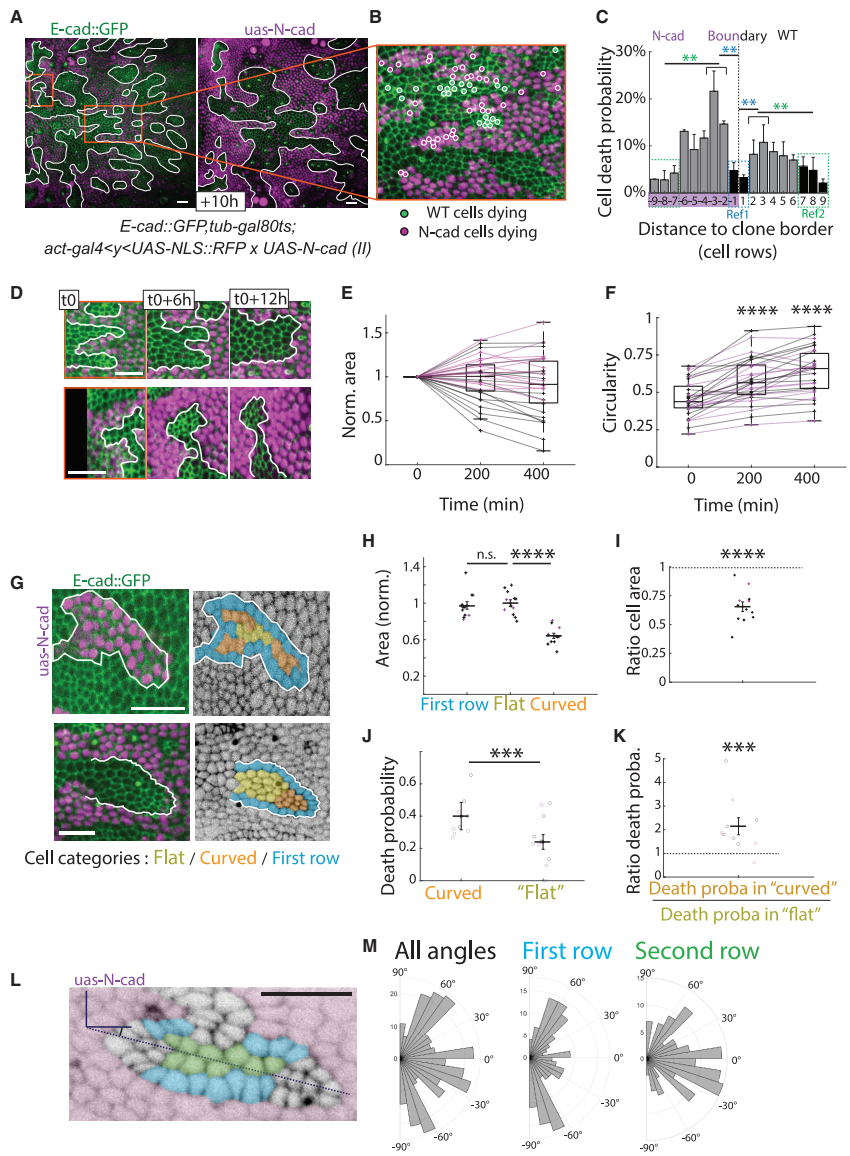
本研究通过果蝇蛹期背板模型和顶点模拟,揭示了机械性细胞竞争(MCC)中两种独立机制:生长驱动和界面张力驱动的细胞压缩。研究人员发现RasV12克隆通过双重机制压缩野生型细胞,而YkiCA和N-cad过表达分别特异性激活生长驱动和张力驱动通路。该研究首次证实界面张力梯度可直接诱导细胞凋亡,为理解肿瘤扩张的机械生物学机制提供了新范式。



 生物通微信公众号
生物通微信公众号
知名企业招聘