
-

生物通官微
陪你抓住生命科技
跳动的脉搏
比较蛋白质组学揭示FB1与HFB1在猪肠上皮细胞中的差异毒性机制及致癌通路调控
【字体: 大 中 小 】 时间:2025年10月11日 来源:Mycotoxin Research 3.1
编辑推荐:
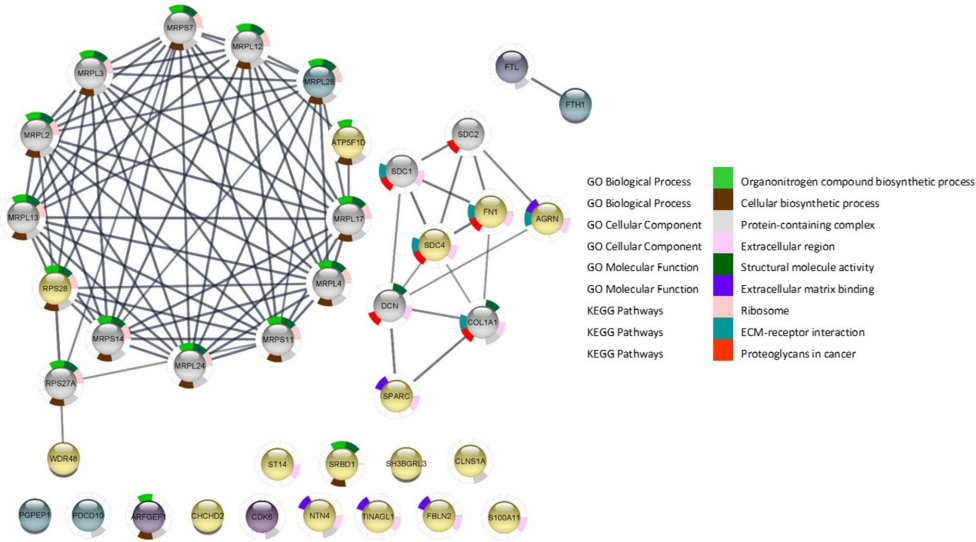
本研究针对伏马毒素B1(FB1)及其水解产物HFB1的毒性差异机制不明确的问题,通过蛋白质组学技术分析猪肠上皮细胞IPEC-J2的分子响应。研究发现HFB1引起更广泛的蛋白表达变化,通过调控纤维连接蛋白1(FN1)、铁代谢蛋白(FTL/FTH1)和细胞外基质相关蛋白(SPARC/SDC4)等靶点,激活PI3K-Akt等癌症相关通路。该研究为阐明两种毒素的毒性机制提供了分子证据,对饲料安全评估和人类健康保护具有重要意义。




 生物通微信公众号
生物通微信公众号
知名企业招聘