
-

生物通官微
陪你抓住生命科技
跳动的脉搏
单细胞与代谢组学整合揭示TGFβ信号通路调控结直肠癌肝转移中氧化磷酸化代谢重编程的关键作用
【字体: 大 中 小 】 时间:2025年10月11日 来源:Cancer & Metabolism 5.3
编辑推荐:
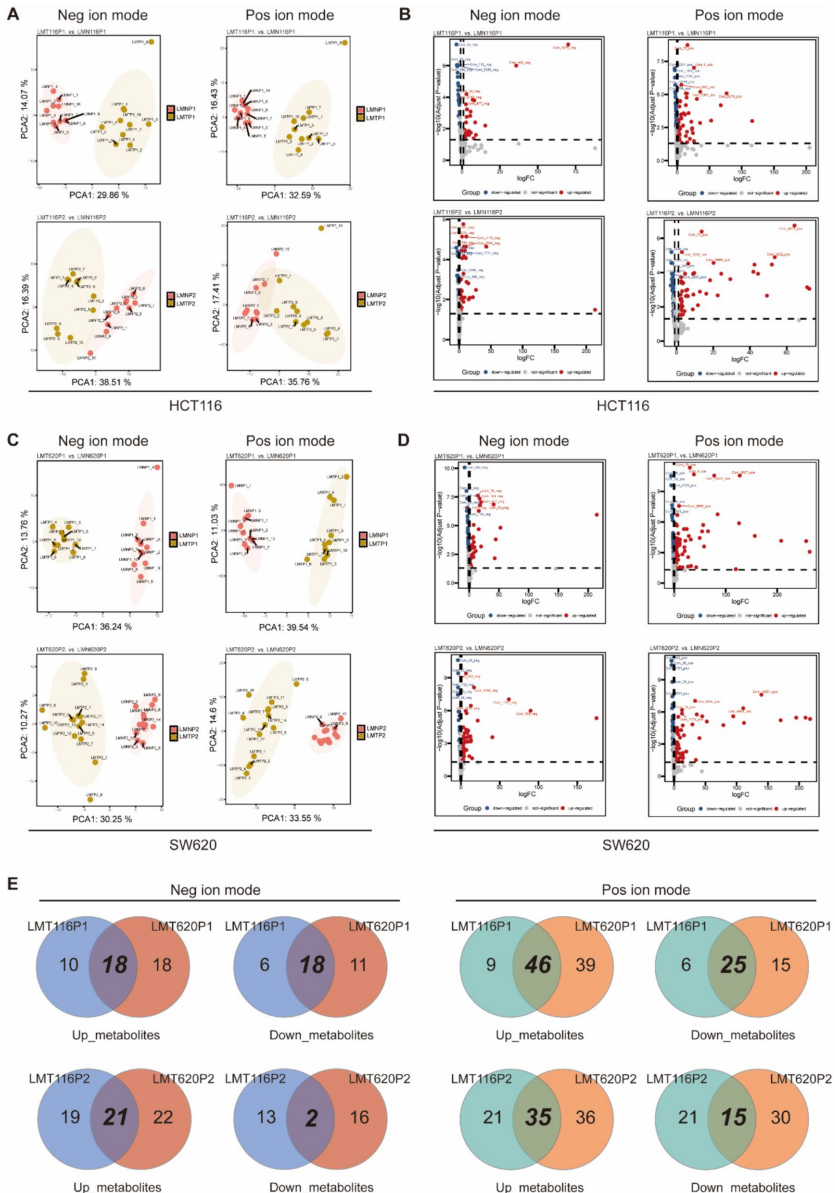
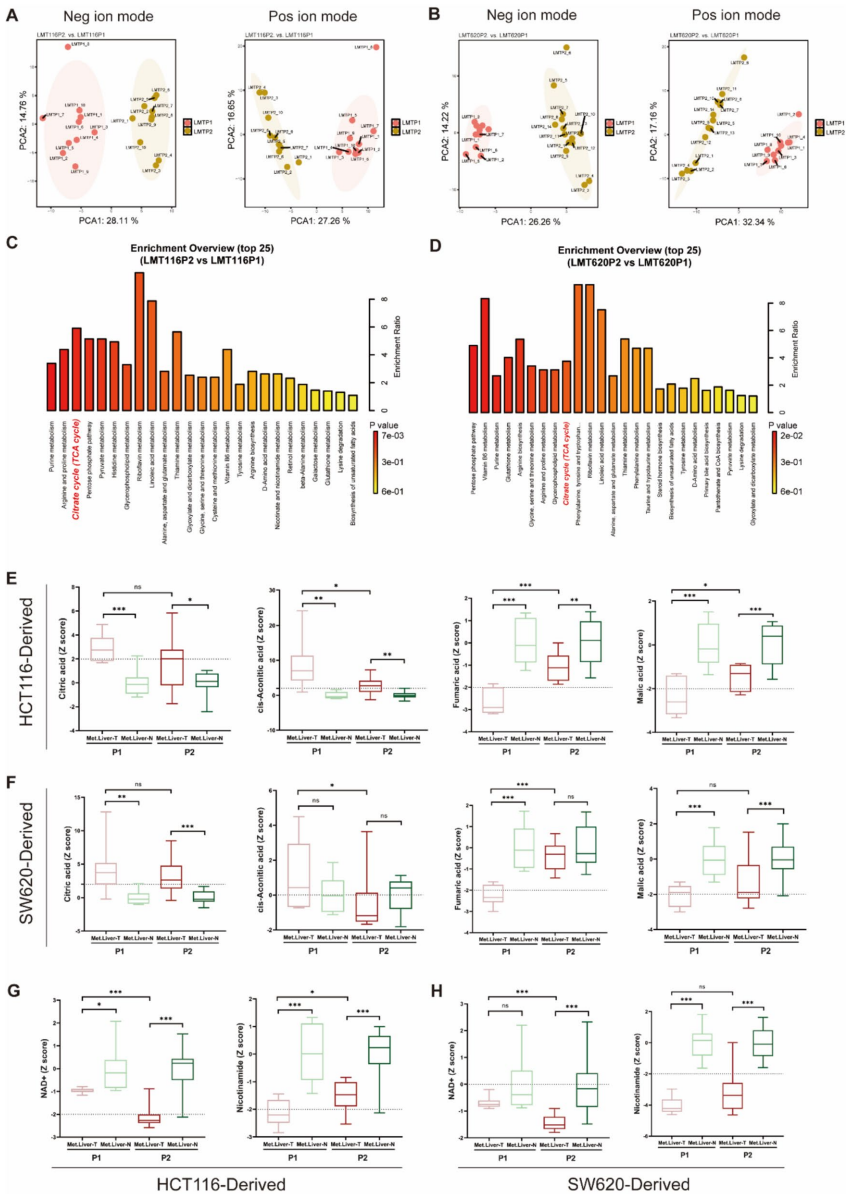
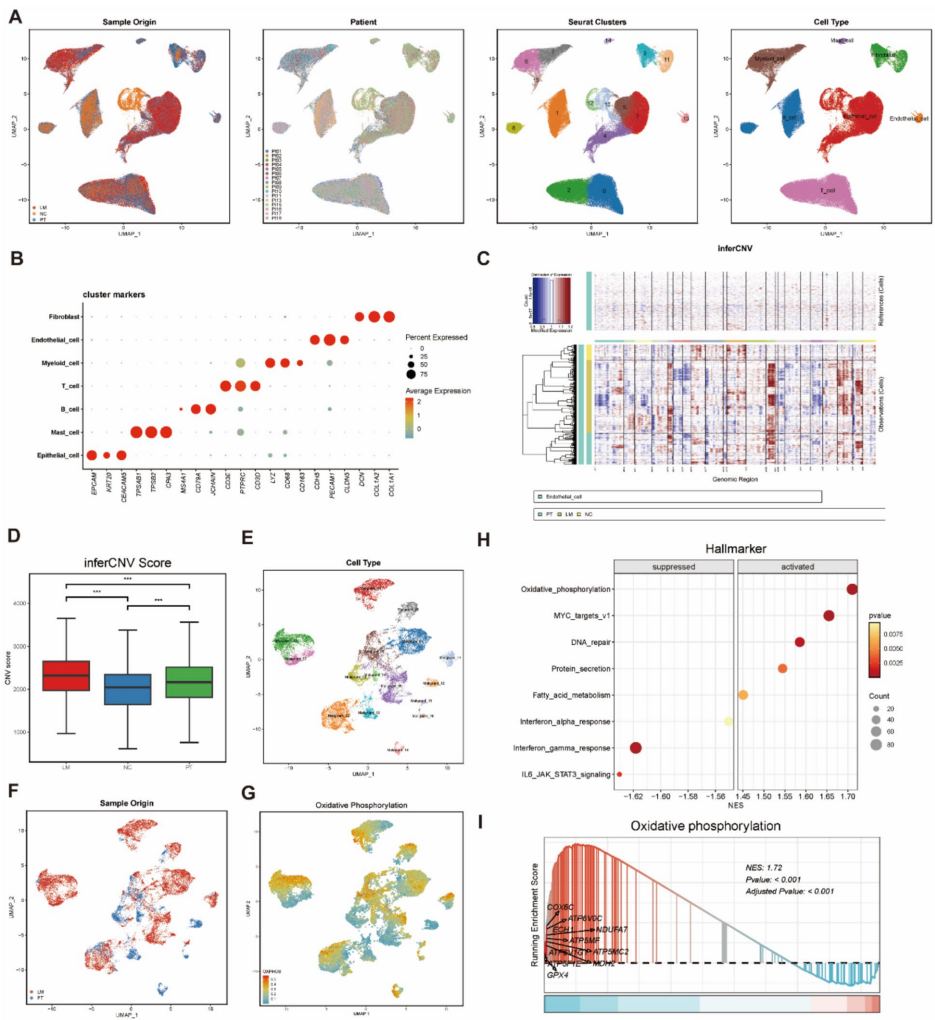
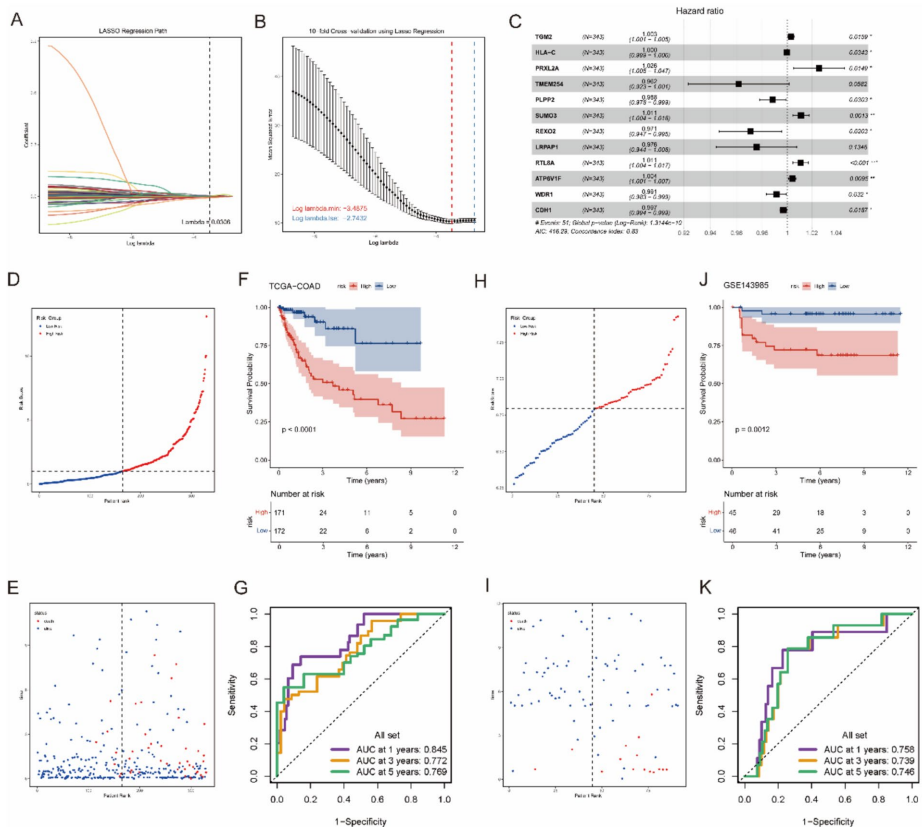
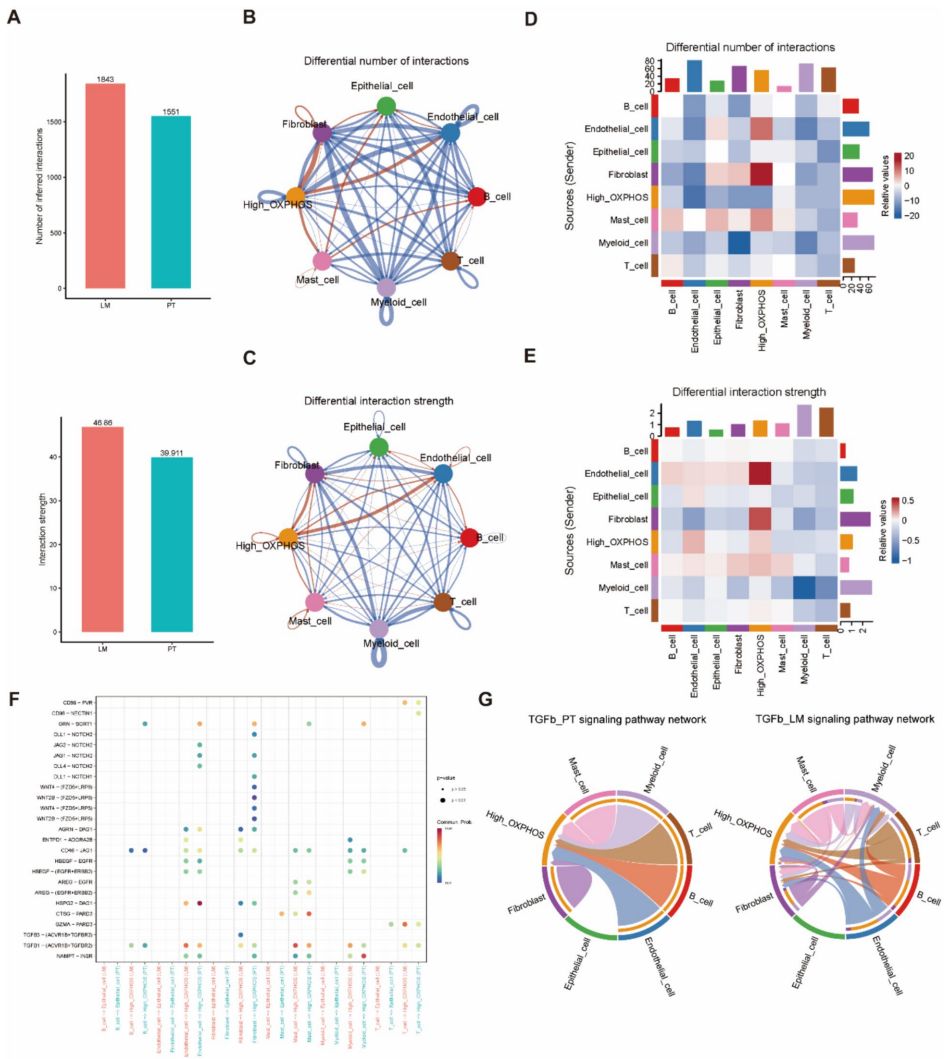
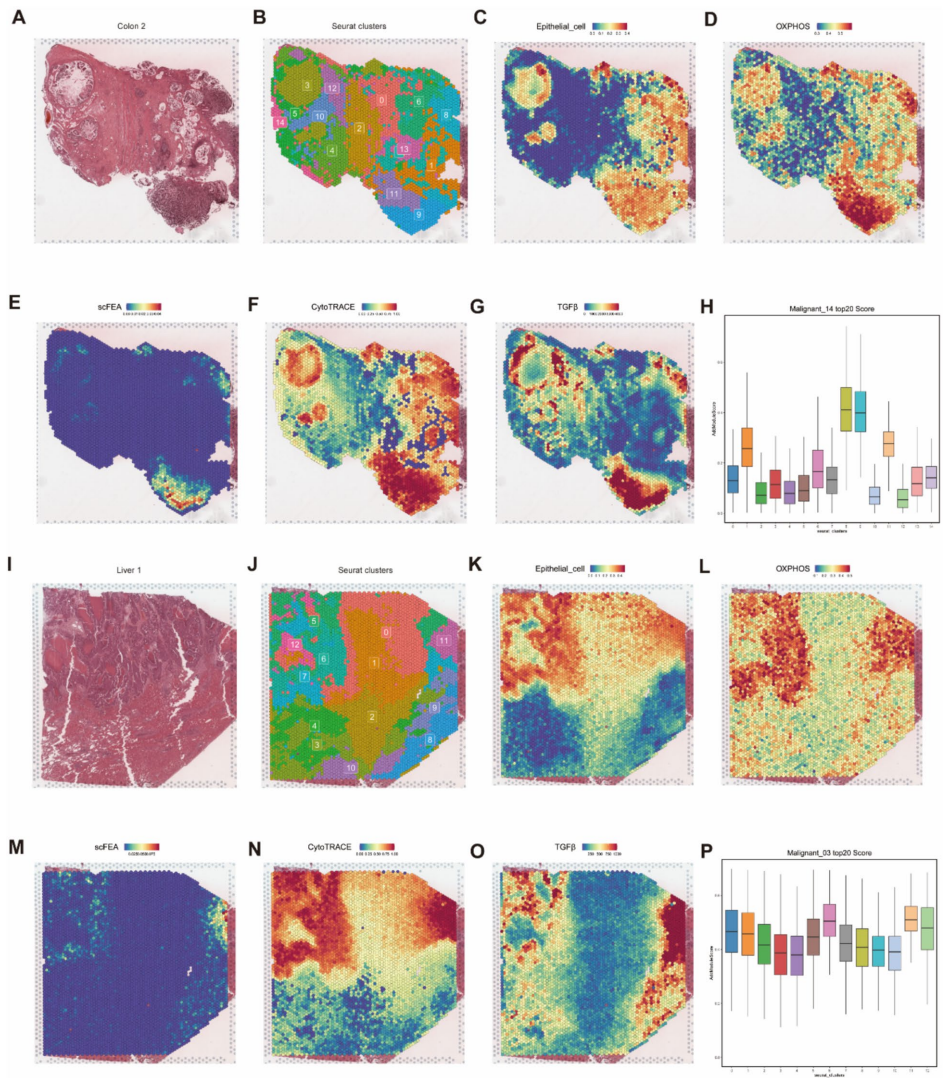
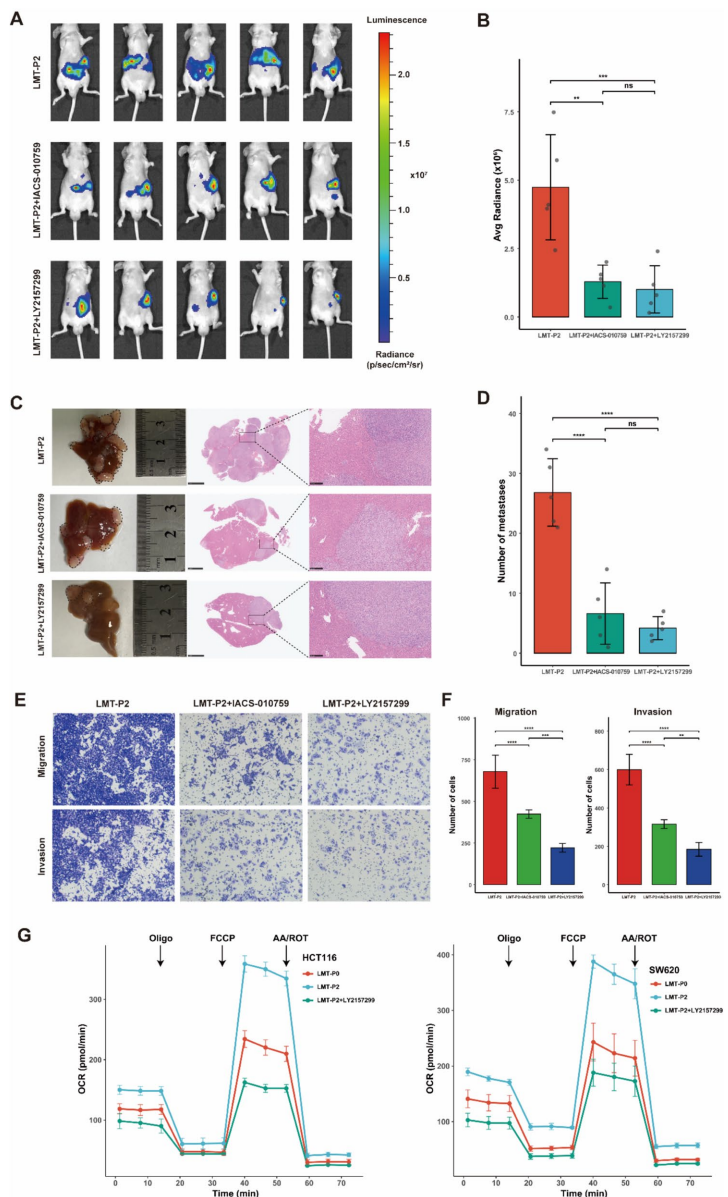
本研究针对结直肠癌肝转移(CRLM)代谢机制不清的难题,通过构建阶梯式小鼠模型,整合代谢组学、单细胞RNA测序(scRNA-seq)和空间转录组学(ST)技术,发现肝转移灶中三羧酸(TCA)循环活性增强并伴随氧化磷酸化(OXPHOS)显著上调。研究进一步鉴定出高OXPHOS恶性上皮细胞亚型,并揭示TGFβ信号通路通过诱导OXPHOS促进转移进程。体内外实验证实抑制TGFβ可降低OXPHOS活性并抑制肝转移,为晚期结直肠癌提供了靶向线粒体代谢的新治疗策略。
 生物通微信公众号
生物通微信公众号
知名企业招聘