
-

生物通官微
陪你抓住生命科技
跳动的脉搏
锰负载碳纳米颗粒通过抑制铁死亡改善ANCA相关性血管炎的作用机制研究
【字体: 大 中 小 】 时间:2025年10月11日 来源:Journal of Nanobiotechnology 12.6
编辑推荐:
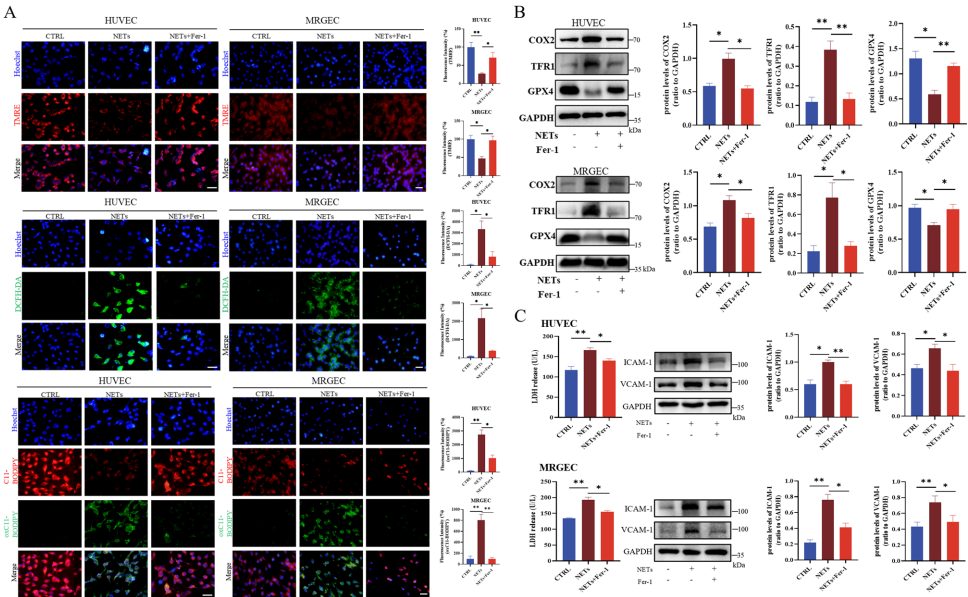
本研究针对ANCA相关性血管炎(AAV)中中性粒细胞胞外诱捕网(NETs)诱导的肾小球内皮细胞损伤机制,开发了锰负载葡萄糖碳纳米颗粒(GCNPs/Mn)。研究发现NETs通过抑制锰超氧化物歧化酶(MnSOD)活性诱发铁死亡(ferroptosis),而GCNPs/Mn通过溶酶体释放锰离子增强MnSOD活性,抑制NF-κB信号通路,显著改善实验性血管炎模型的肾功能损伤和脂质过氧化,为AAV治疗提供了新型纳米靶向策略。







 生物通微信公众号
生物通微信公众号
知名企业招聘