
-

生物通官微
陪你抓住生命科技
跳动的脉搏
靶向cGAS-STING通路的载药氧化铈纳米酶通过抑制线粒体氧化损伤和炎症反应预防辐射性白内障
【字体: 大 中 小 】 时间:2025年10月11日 来源:Journal of Nanobiotechnology 12.6
编辑推荐:
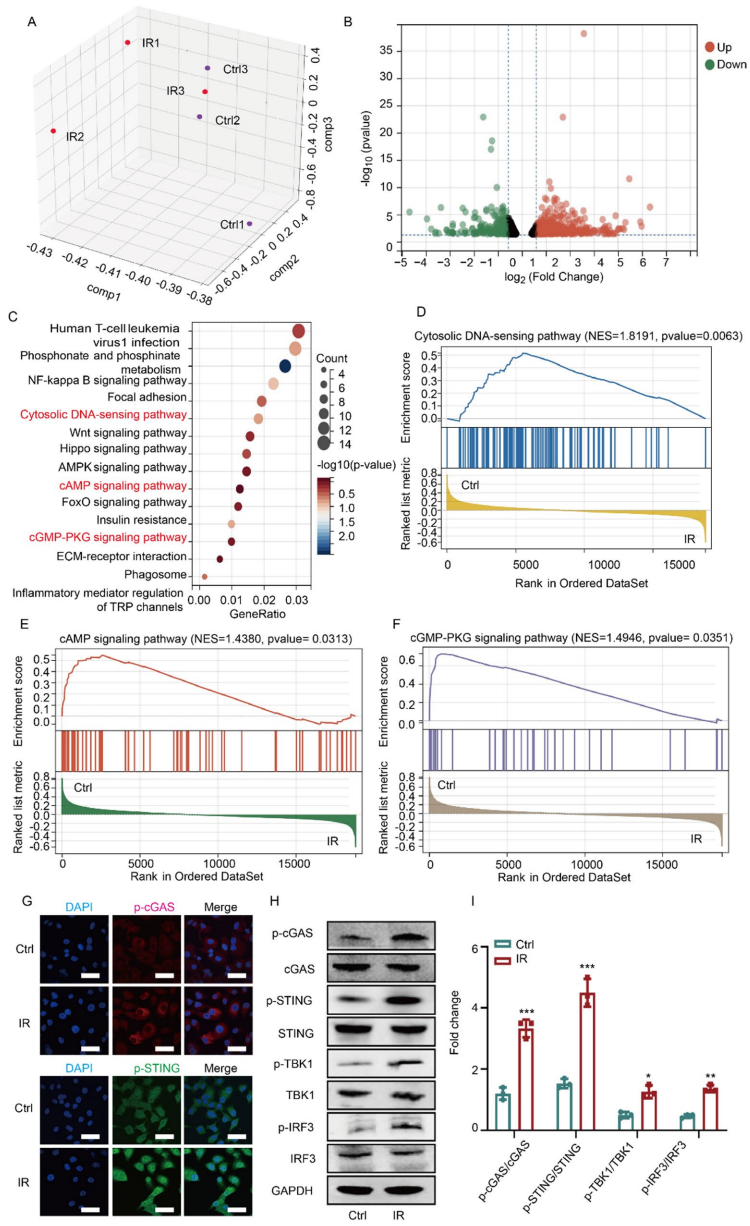
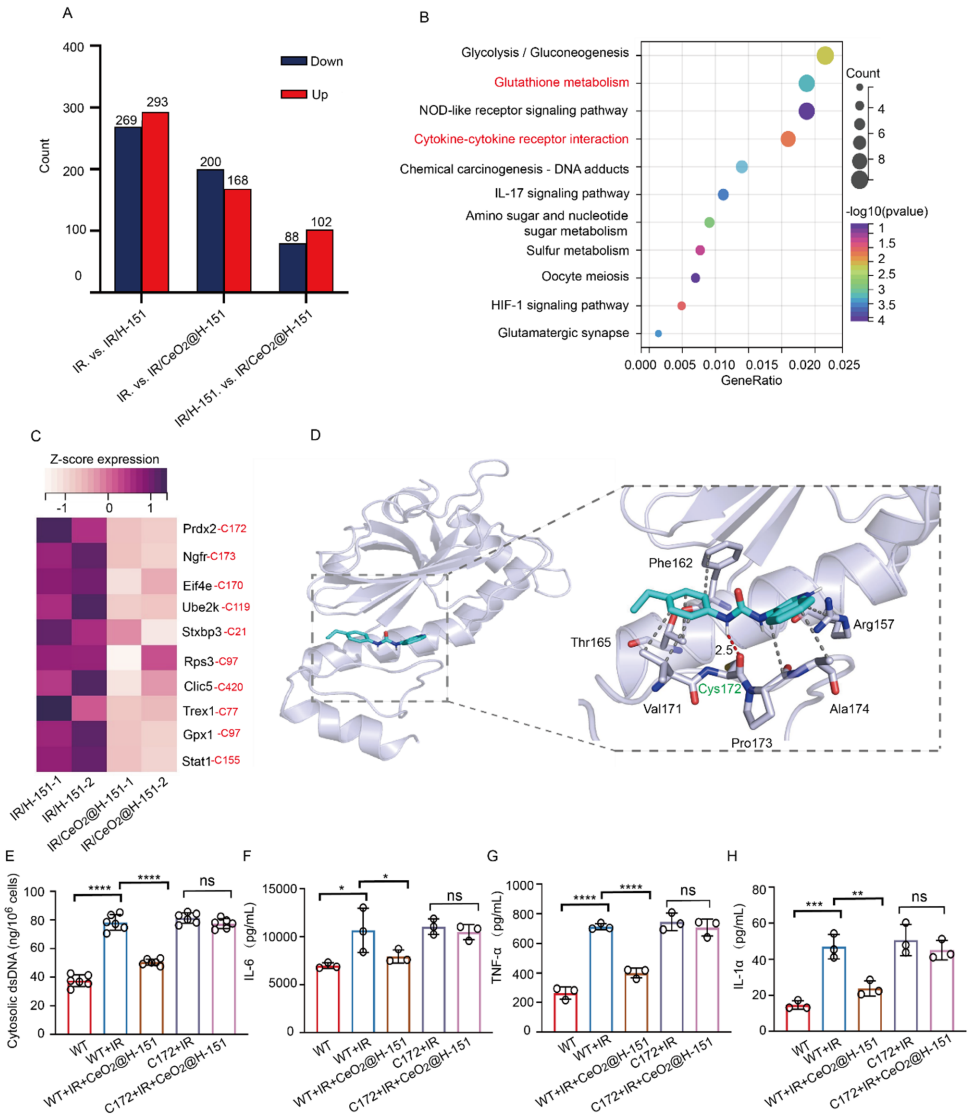
本研究针对辐射性白内障(RIC)缺乏有效靶向治疗药物的临床难题,开发了负载STING抑制剂H-151的中空介孔氧化铈纳米酶(CeO2@H-151)。研究人员首次证实电离辐射(IR)通过激活cGAS-STING通路驱动线粒体氧化应激和胞质dsDNA积累,进而导致晶状体上皮细胞(LECs)损伤。该纳米酶系统不仅能通过Ce3+/Ce4+氧化还原循环清除ROS,还能控制释放H-151抑制炎症反应,并通过结合PRDX2蛋白Cys172位点维持蛋白质稳态。体内外实验表明,CeO2@H-151能有效预防晶状体混浊,为RIC防治提供了协同抗氧化-抗炎症的新型纳米治疗策略。




 生物通微信公众号
生物通微信公众号
知名企业招聘