
-

生物通官微
陪你抓住生命科技
跳动的脉搏
综述:构建用于肝脏再生的仿生微环境
【字体: 大 中 小 】 时间:2025年10月11日 来源:Journal of Nanobiotechnology 12.6
编辑推荐:
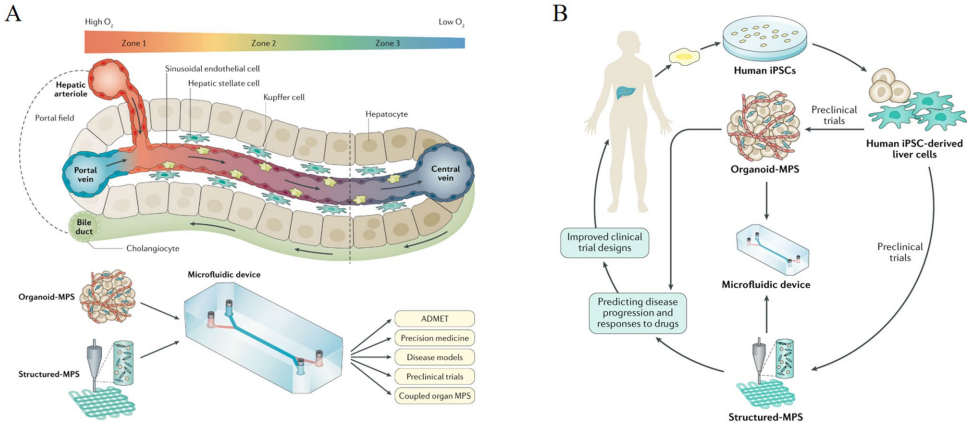
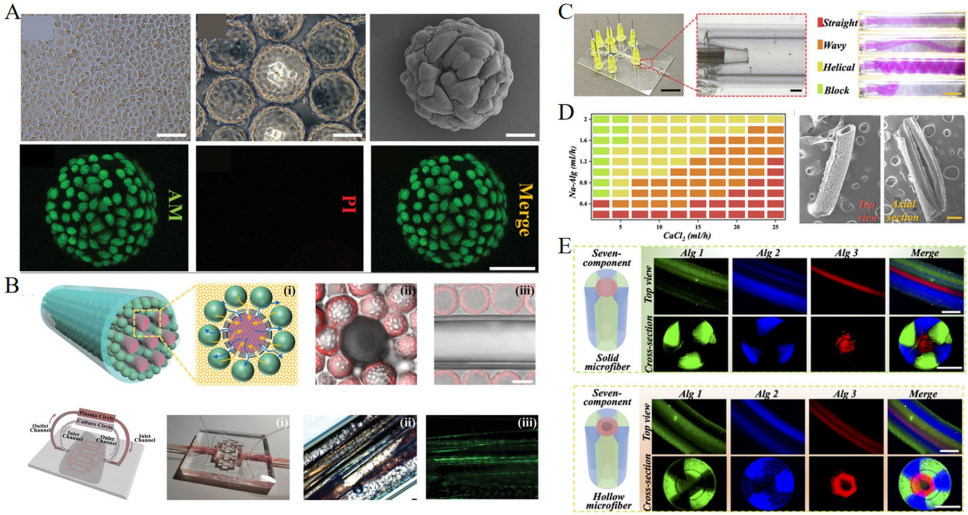
本综述系统阐述了肝脏再生领域的最新进展,重点介绍了如何通过组织工程技术构建仿生微环境来模拟肝脏天然结构并支持肝细胞功能。文章深入探讨了肝脏损伤的病理特征(如MASLD、ALD、ALF、肝硬化及HCC)及再生关键调控机制(细胞可塑性、ECM重塑、免疫互作),并评述了前沿仿生策略(3D细胞共培养、脱细胞ECM水凝胶、生物打印、动态培养系统如中空纤维/流化床/微载体生物反应器及肝脏芯片)。尽管取得显著进展,但在优化微环境保真度、确保临床可扩展性及转化实验室突破方面仍面临挑战。











 生物通微信公众号
生物通微信公众号
知名企业招聘