
-

生物通官微
陪你抓住生命科技
跳动的脉搏
黑豆防御素蛋白通过"瓶塞"机制抑制豇豆象α-淀粉酶的计算机模拟与杀虫活性研究
【字体: 大 中 小 】 时间:2025年10月11日 来源:Scientific Reports 3.9
编辑推荐:
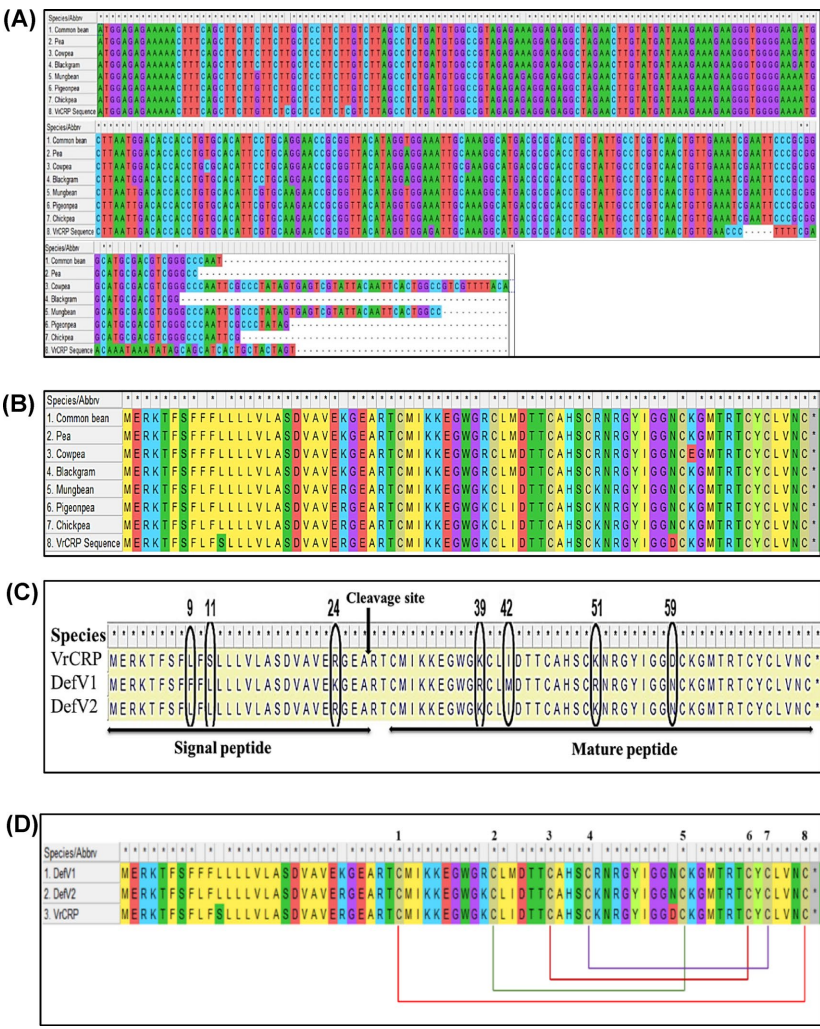
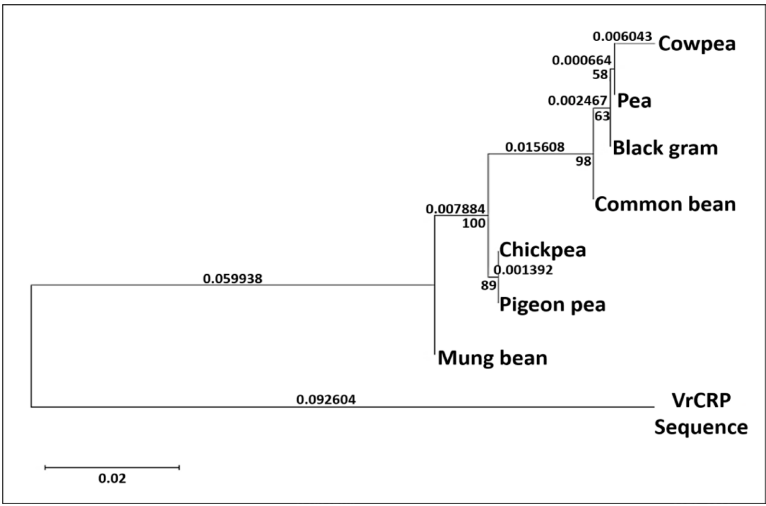
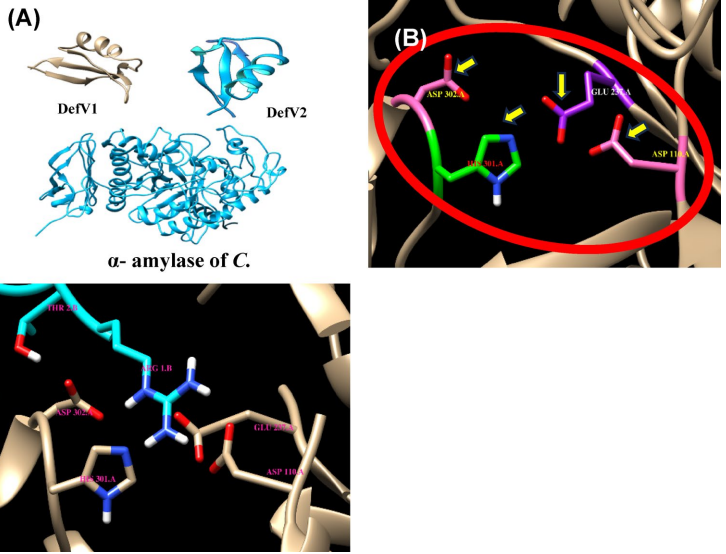
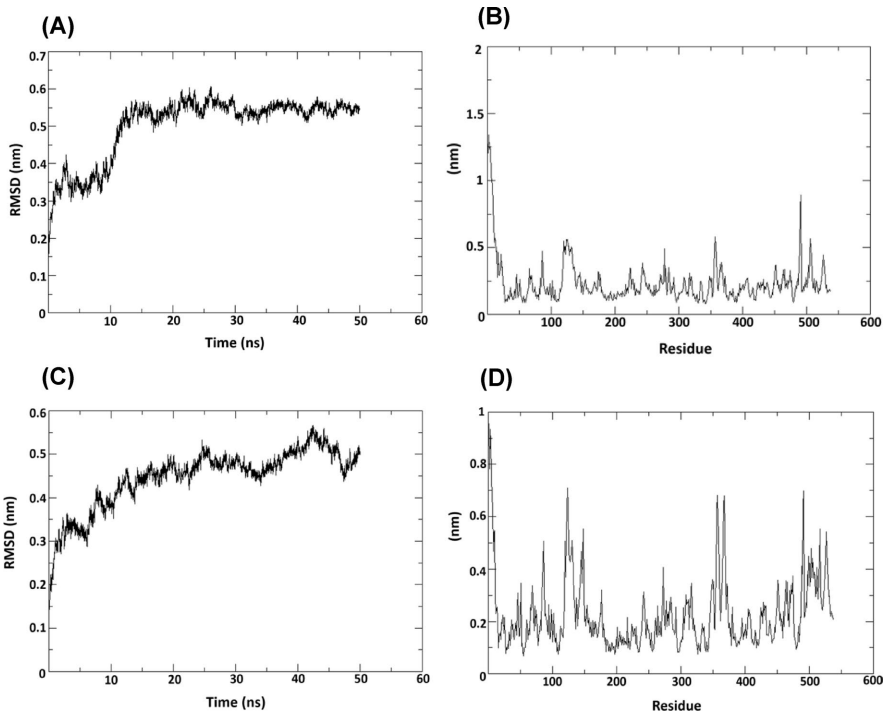
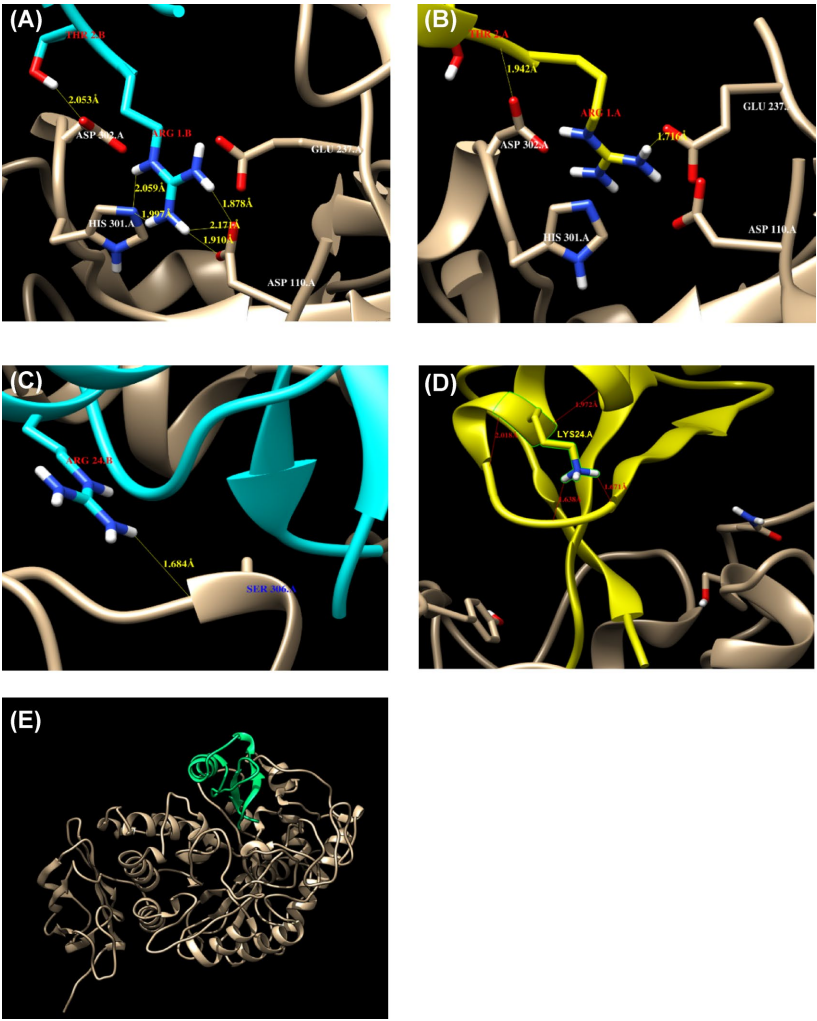
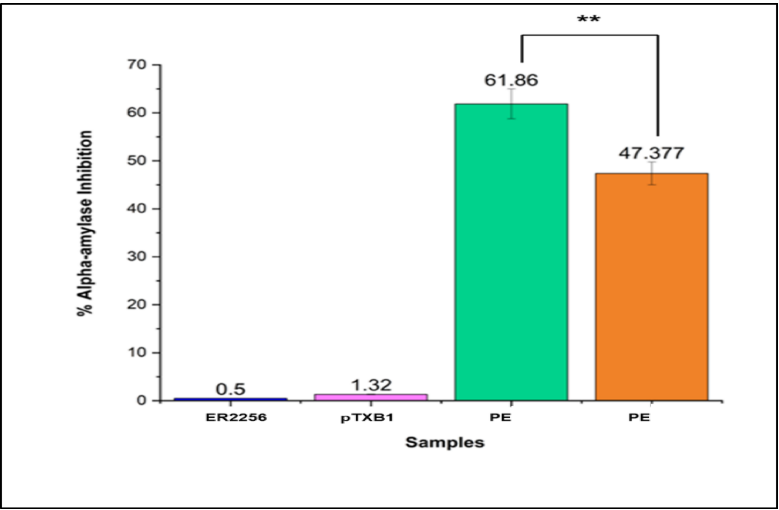
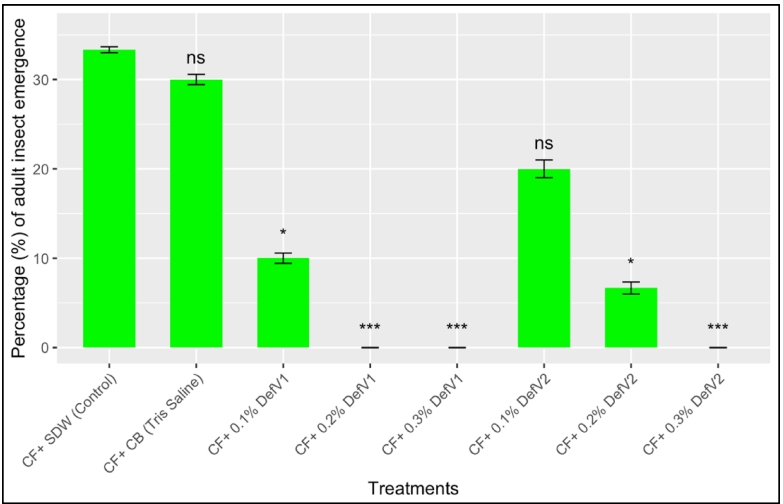
本研究针对豆类仓储害虫豇豆象(Callosobruchus maculatus)防治难题,通过克隆测序获得黑豆防御素基因DefV1/DefV2变异体,结合分子对接、分子动力学模拟和昆虫生物测定,揭示DefV1通过"瓶塞"机制与昆虫α-淀粉酶活性位点(H301、E237、D110、D302)形成氢键网络,抑制效率达61.86%,0.3%浓度可完全阻止成虫羽化,为豆类抗虫育种提供新策略。
 生物通微信公众号
生物通微信公众号
知名企业招聘