
-

生物通官微
陪你抓住生命科技
跳动的脉搏
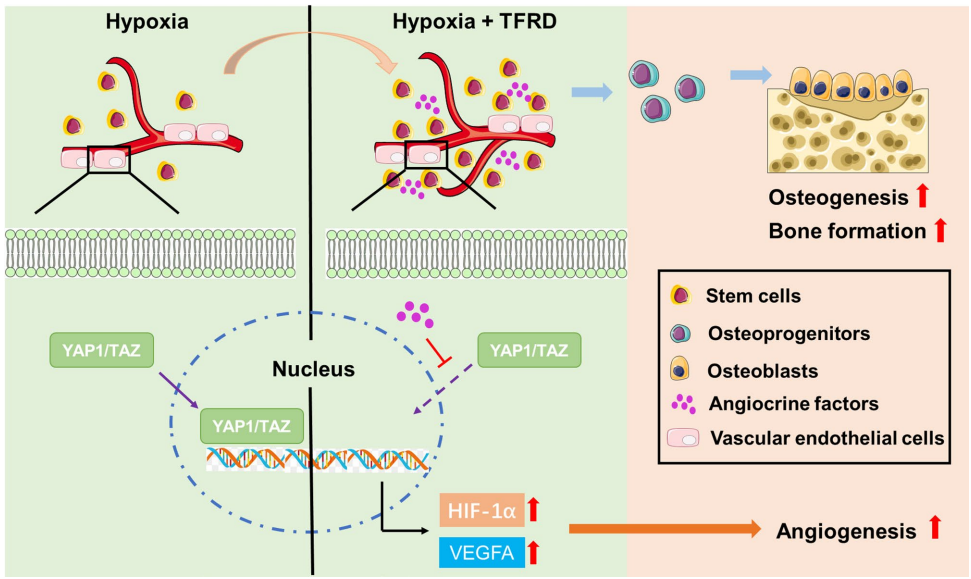
骨碎补总黄酮通过YAP1/TAZ/HIF-1α通路增强BMSCs成骨与促血管生成能力加速长骨再生
【字体: 大 中 小 】 时间:2025年10月12日 来源:Scientific Reports 3.9
编辑推荐:
本研究针对骨缺损修复中血管生成-成骨耦联机制不清的难题,探讨了骨碎补总黄酮(TFRD)通过调控骨髓间充质干细胞(BMSCs)旁分泌途径抑制内皮细胞YAP1/TAZ表达,进而激活HIF-1α信号通路促进血管生成的新机制。研究人员通过建立小鼠单皮质胫骨缺损模型,结合micro-CT、免疫荧光染色和细胞功能实验,发现TFRD不仅能直接增强BMSCs的成骨分化能力,还能通过旁分泌作用改善缺氧环境下内皮细胞的迁移、增殖和成管功能。该研究为TFRD的临床应用提供了新的理论依据,发表于《Scientific Reports》。







 生物通微信公众号
生物通微信公众号
知名企业招聘