
-

生物通官微
陪你抓住生命科技
跳动的脉搏
雌激素相关受体基因表达与孤立性REM睡眠行为障碍皮质萎缩的性别差异相关联
【字体: 大 中 小 】 时间:2025年10月12日 来源:Nature Communications 15.7
编辑推荐:
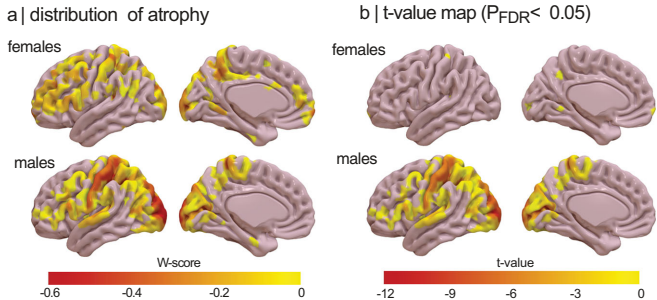
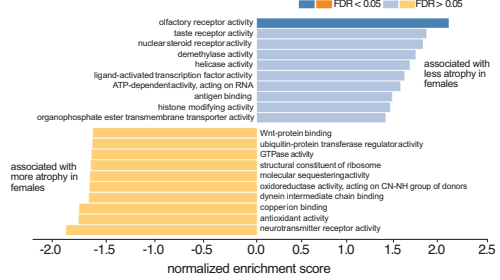
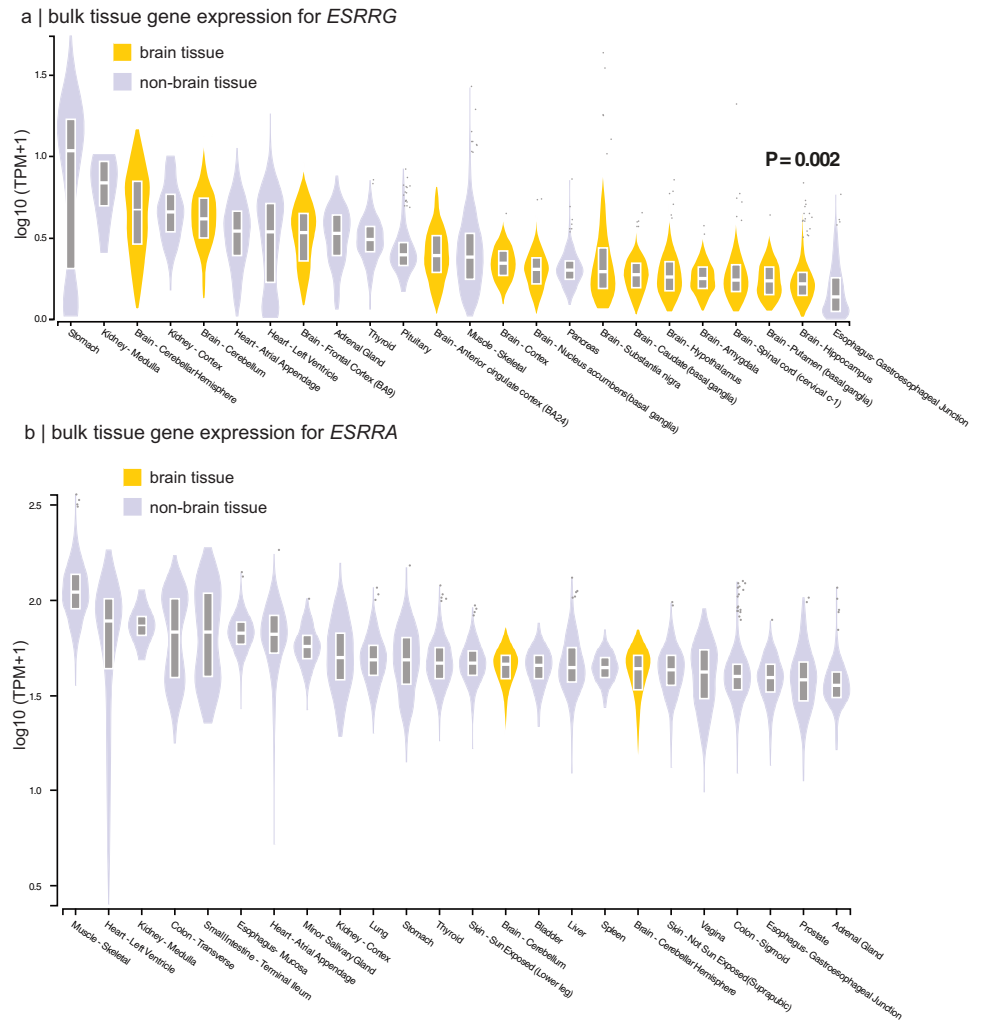
本研究针对孤立性REM睡眠行为障碍(iRBD)这一突触核蛋白病最强前驱标志物,通过国际多中心888例MRI数据分析,首次揭示男性患者较女性出现更广泛严重的皮质萎缩。成像转录组学发现女性患者受累区域与健康脑中雌激素相关受体基因(ESRRG/ESRRα)高表达区域高度吻合,为前驱期突触核蛋白病的性别特异性神经保护机制提供了重要依据。
 生物通微信公众号
生物通微信公众号
知名企业招聘