
-

生物通官微
陪你抓住生命科技
跳动的脉搏
综述:F-box蛋白在癌症中的作用:从癌细胞到肿瘤微环境
【字体: 大 中 小 】 时间:2025年10月15日 来源:Cell Communication and Signaling 8.9
编辑推荐:
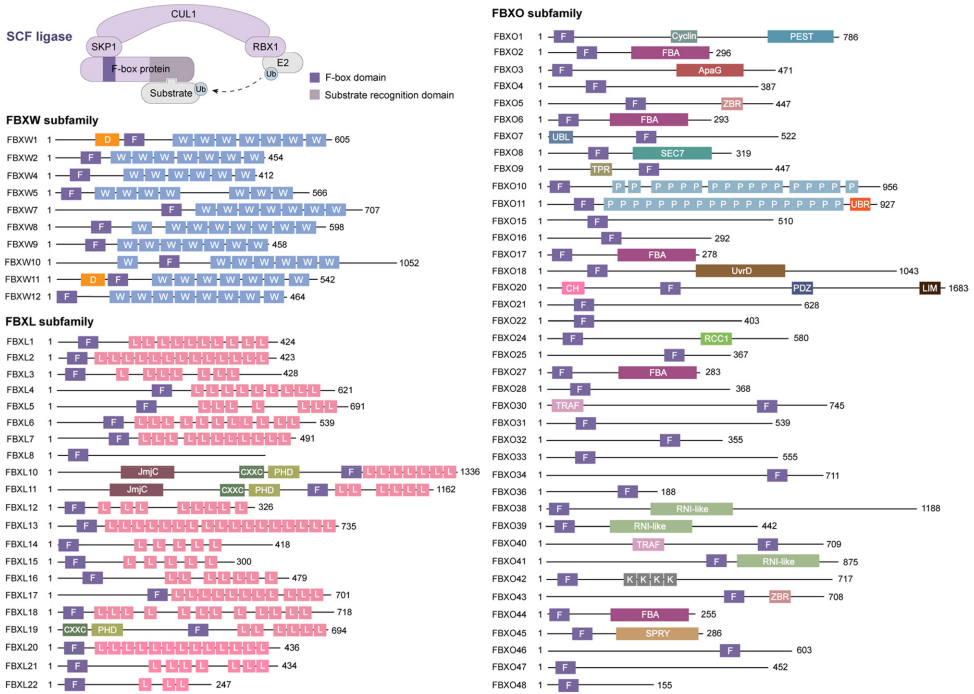
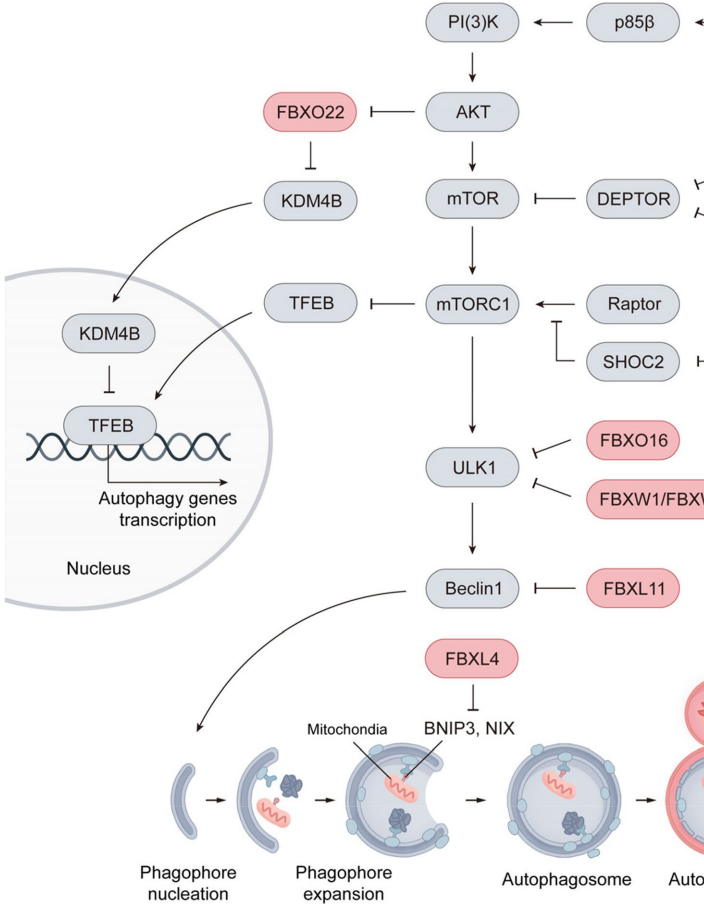
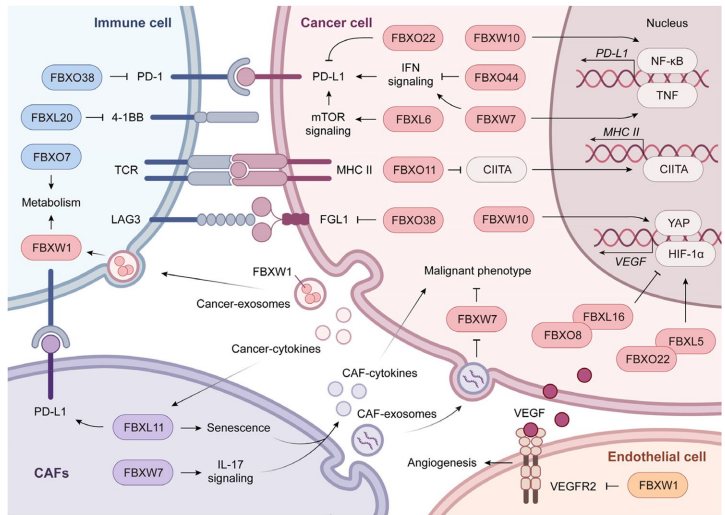
本综述系统阐述了F-box蛋白通过泛素化修饰在癌症中的多维调控作用。文章突破传统视角,不仅涵盖癌细胞自身行为(增殖、死亡、代谢重编程等),更拓展至肿瘤微环境(TME)调控,揭示了F-box蛋白在肿瘤免疫、血管生成及癌相关成纤维细胞(CAF)相互作用中的关键角色。作者强调了其作为E3泛素连接酶SCF复合物的底物识别模块,通过复杂的调控层级网络,在癌症治疗靶点开发(如PROTAC技术)中展现巨大潜力。

 生物通微信公众号
生物通微信公众号
知名企业招聘