
-

生物通官微
陪你抓住生命科技
跳动的脉搏
基于miR-10a脂质体重编程巨噬细胞线粒体代谢与表观遗传以治疗动脉粥样硬化
【字体: 大 中 小 】 时间:2025年10月15日 来源:Nature Communications 15.7
编辑推荐:
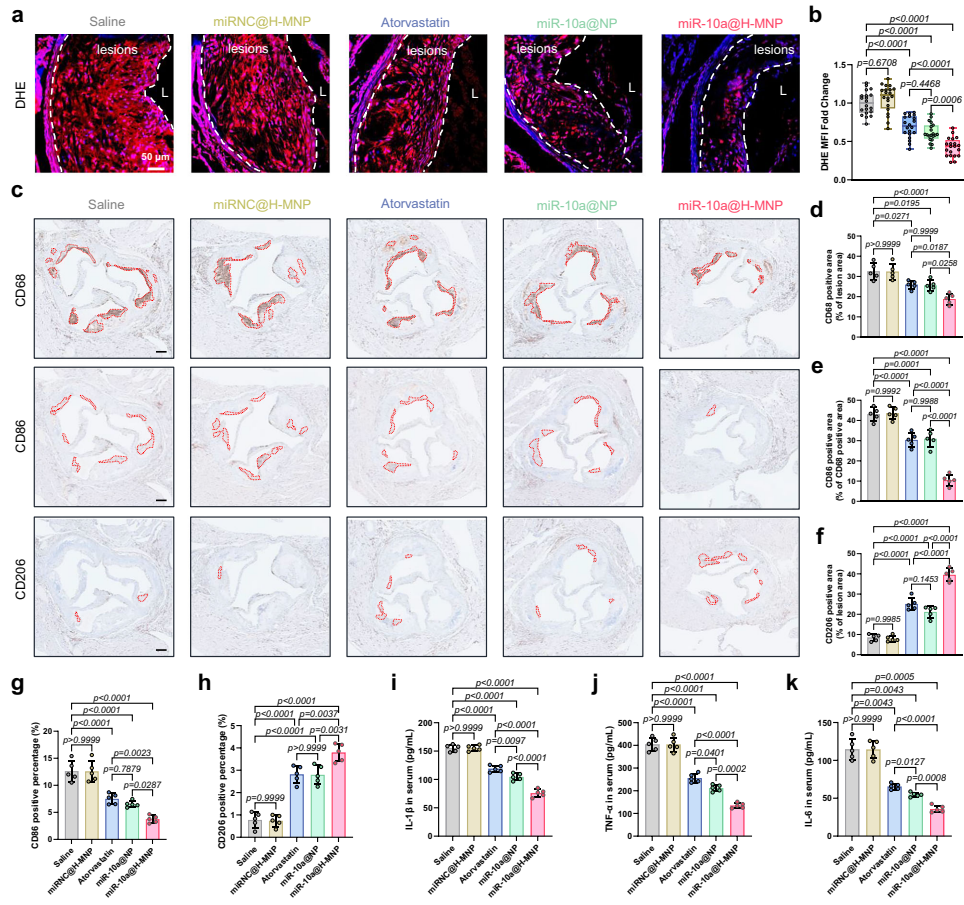
本研究针对动脉粥样硬化中巨噬细胞表型动态失衡导致的慢性炎症难题,开发了红细胞膜修饰的透明质酸靶向性脂质体纳米颗粒(miR-10a@H-MNP),通过恢复线粒体氧化磷酸化(OXPHOS)功能增加组蛋白乙酰化(H3K9Ac),重塑染色质可及性,成功将促炎型巨噬细胞重编程为抗炎表型,显著减轻小鼠动脉粥样硬化进展,为代谢性表观遗传调控治疗提供了新策略。





 生物通微信公众号
生物通微信公众号
知名企业招聘