
-

生物通官微
陪你抓住生命科技
跳动的脉搏
综述:大黄抗动脉粥样硬化多靶点作用机制的传统疗法新探
【字体: 大 中 小 】 时间:2025年10月17日 来源:Chinese Medicine 5.7
编辑推荐:
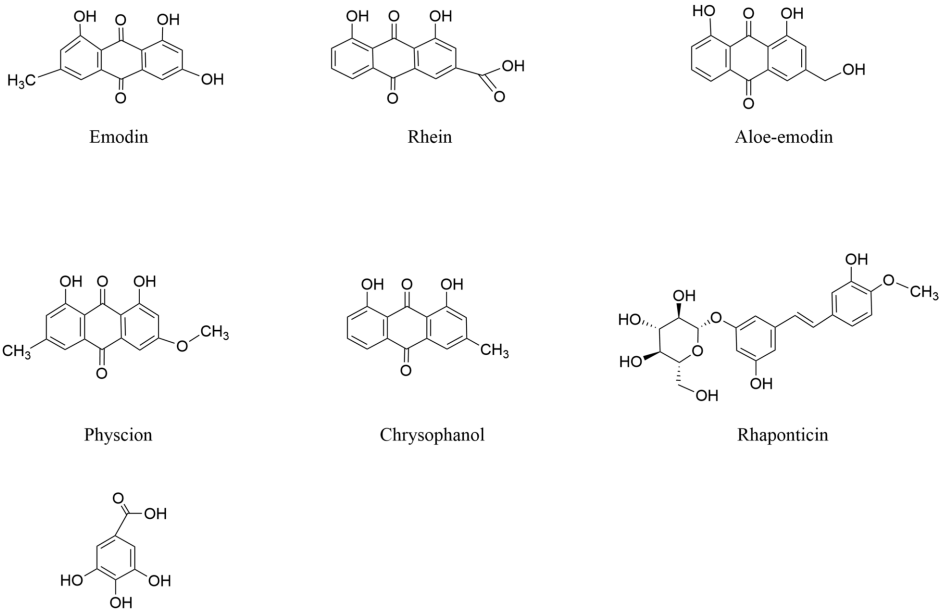
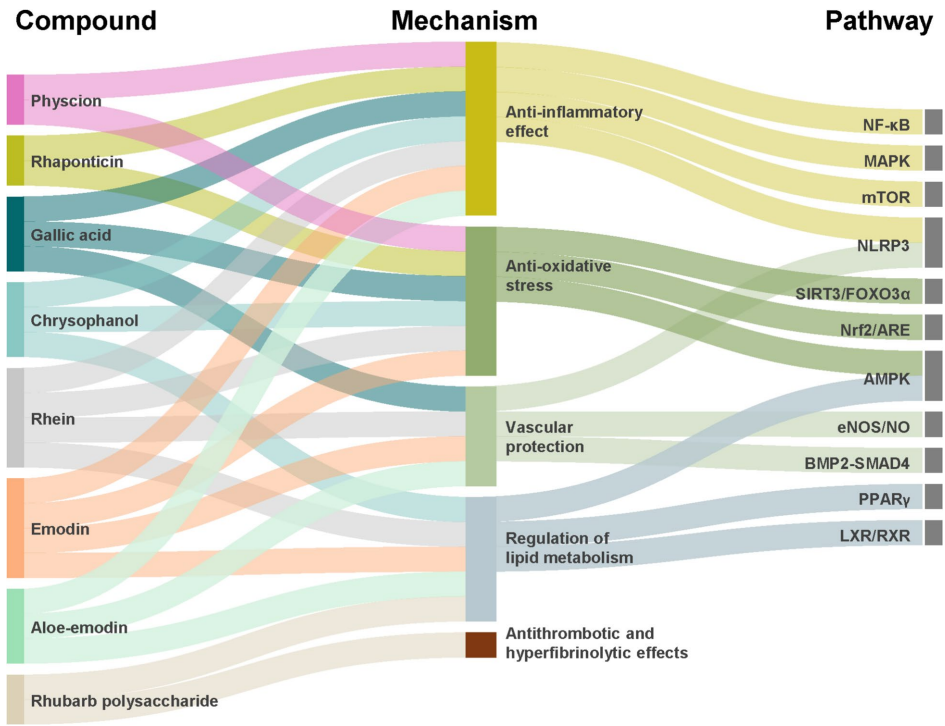
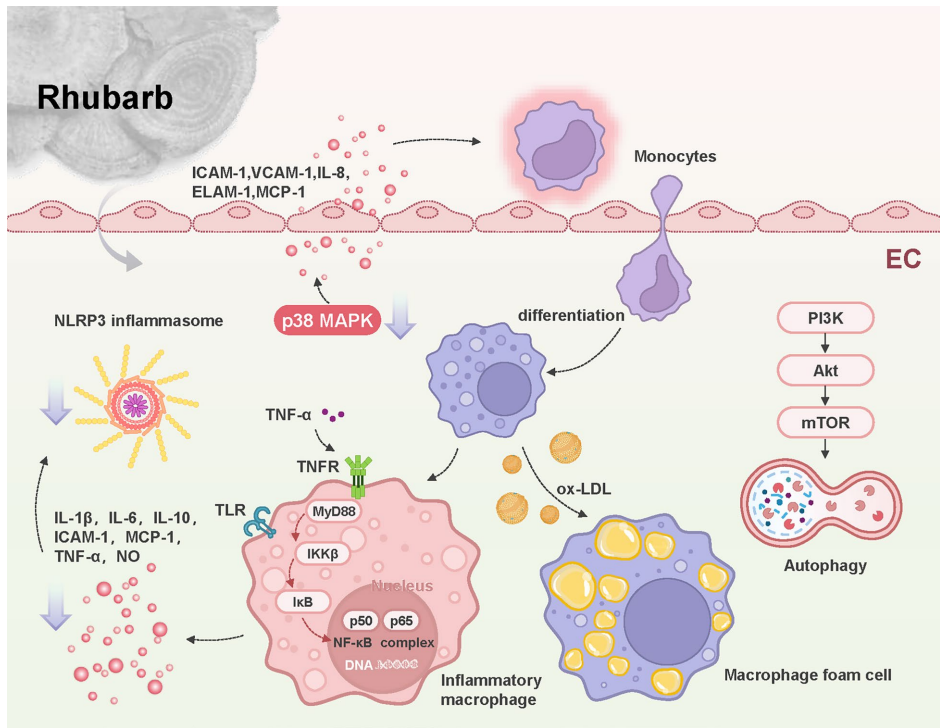
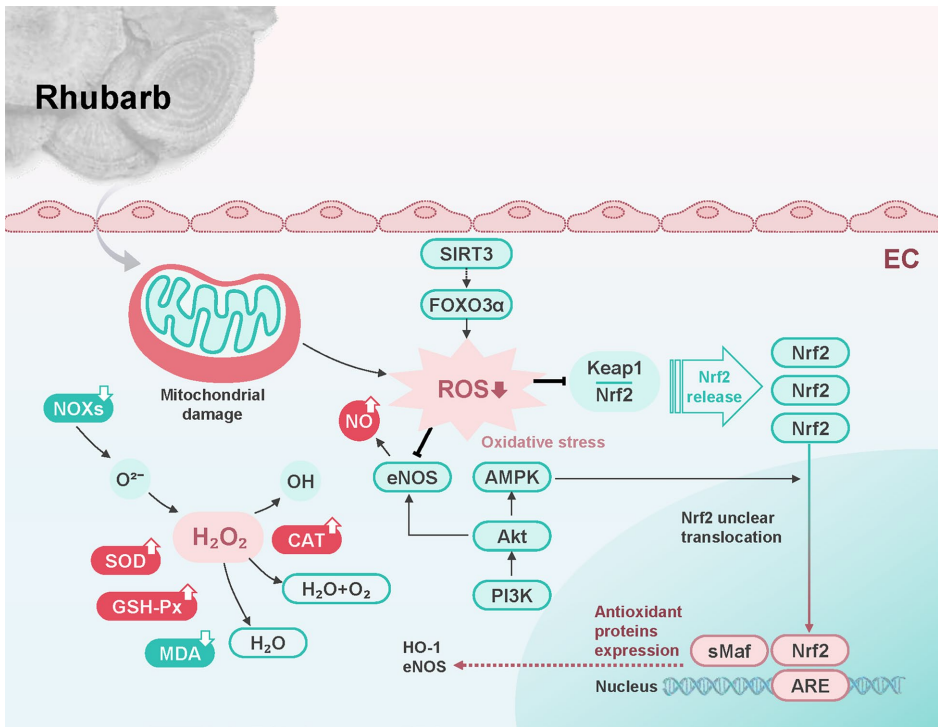
本综述系统梳理了传统中药大黄(Rhubarb)及其主要活性成分(如蒽醌类、二蒽酮类、芪类、鞣质等)在抗动脉粥样硬化(AS)中的多靶点作用机制。文章重点阐述了其通过调控核因子κB(NF-κB)、丝裂原活化蛋白激酶(MAPK)、磷脂酰肌醇3-激酶(PI3K)/蛋白激酶B(Akt)/哺乳动物雷帕霉素靶蛋白(mTOR)等信号通路,发挥抗炎、抗氧化应激、调节脂质代谢、保护血管内皮及抗血栓等多重药理效应,为AS的防治及创新药物研发提供了有价值的参考。

 生物通微信公众号
生物通微信公众号
知名企业招聘