
-

生物通官微
陪你抓住生命科技
跳动的脉搏
综述:缺氧诱导的microRNA(hypoxamiRs):在生理适应和病理机制中的多组织作用
【字体: 大 中 小 】 时间:2025年10月19日 来源:Cell Death & Disease 9.6
编辑推荐:
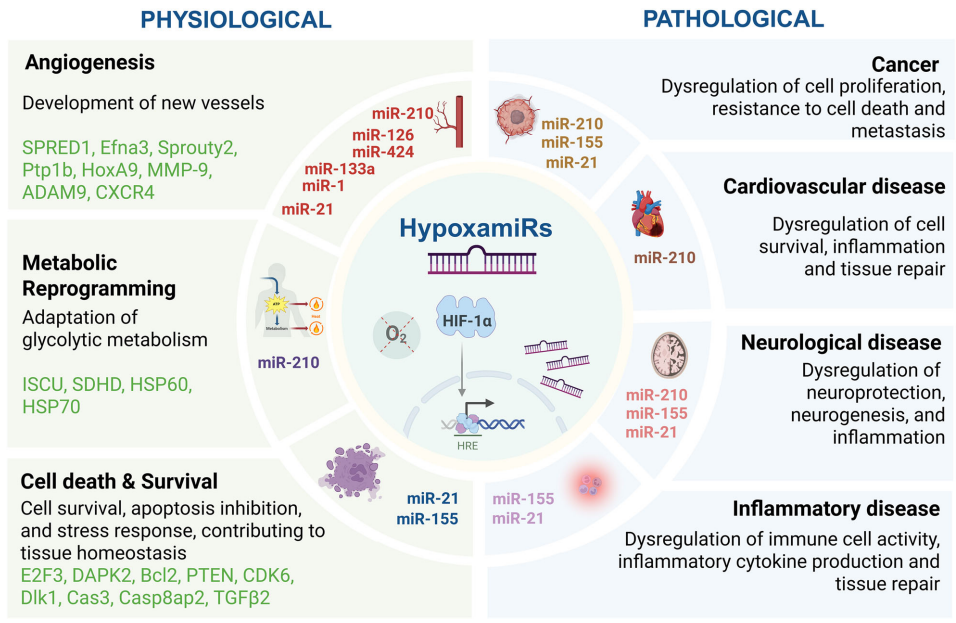
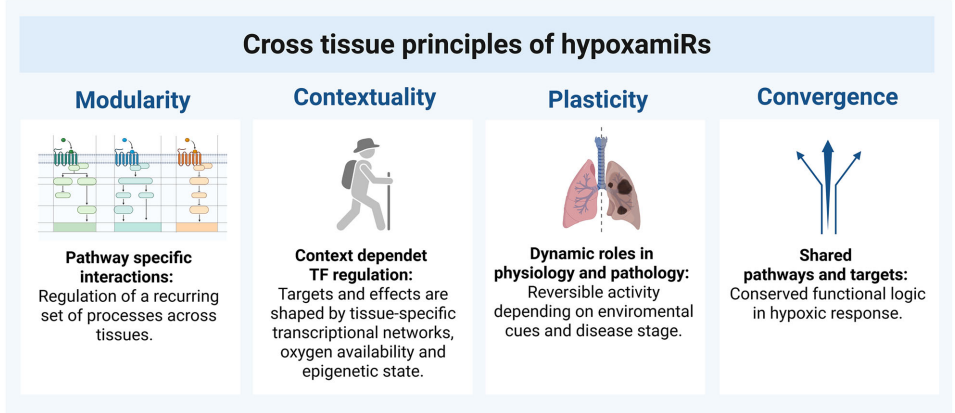
这篇综述系统阐述了缺氧诱导microRNA(hypoxamiRs)作为细胞氧感知与应答的核心介质,其通过模块化、情境依赖性及可塑性调控机制,在心血管、神经、肿瘤等多组织中协调HIF-1α信号通路,调控血管新生(如miR-210靶向EFNA3)、代谢重编程(如miR-210抑制ISCU)及细胞命运决定,既是疾病生物标志物(如miR-210在肿瘤预后评估),亦为靶向缺氧微环境(如miR-155抑制剂Cobomarsen)的精准治疗提供新策略。
 生物通微信公众号
生物通微信公众号
知名企业招聘