
-

生物通官微
陪你抓住生命科技
跳动的脉搏
综述:铁死亡:分子机制、病理生理学及其在儿科肺部疾病中的作用
【字体: 大 中 小 】 时间:2025年10月29日 来源:Cell Biology and Toxicology 5.9
编辑推荐:
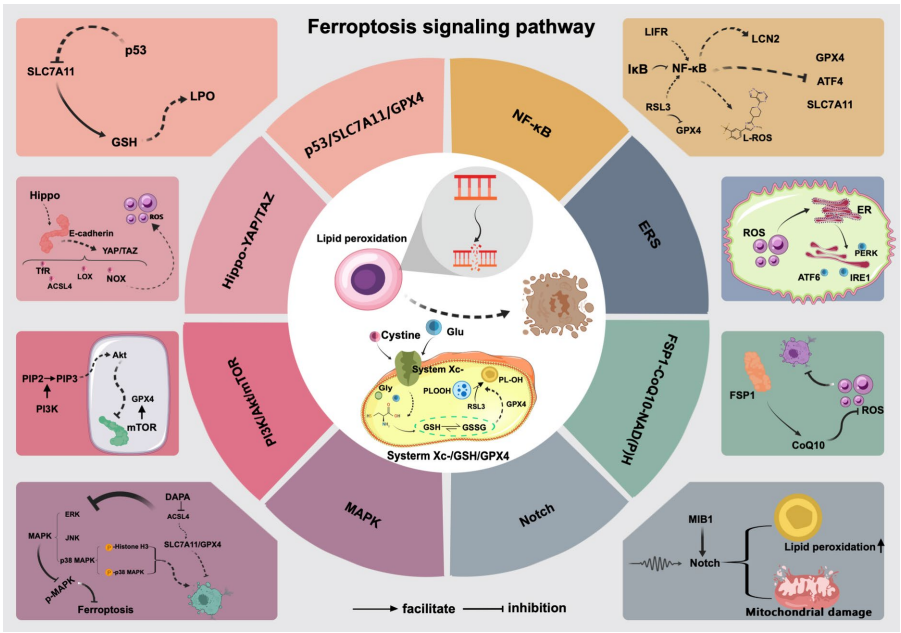
本综述系统阐述了铁死亡(Ferroptosis)这一铁依赖性、脂质过氧化(LPO)驱动的程序性细胞死亡形式。文章深入探讨了其核心分子机制,包括铁代谢、活性氧(ROS)生成、谷胱甘肽(GSH)/谷胱甘肽过氧化物酶4(GPX4)轴、p53/SLC7A11/GPX4信号轴以及FSP1-CoQ10-NADPH通路等关键调控网络。重点分析了铁死亡在儿童哮喘、呼吸道感染(如结核分枝杆菌MtB、COVID-19、铜绿假单胞菌PA)、间质性肺病(ILD)、肺动脉高压(PAH)、急性肺损伤/急性呼吸窘迫综合征(ALI/ARDS)、支气管肺发育不良(BPD)及囊性纤维化(CF)等常见儿科肺部疾病中的潜在病理生理学角色,并展望了以铁死亡为靶点的潜在治疗策略,为儿科呼吸系统疾病的防治提供了新视角。



 生物通微信公众号
生物通微信公众号
知名企业招聘