
-

生物通官微
陪你抓住生命科技
跳动的脉搏
日本人群心力衰竭基因组学研究揭示疾病异质性并实现预后预测
《Nature Communications》:Genome-wide analysis of heart failure yields insights into disease heterogeneity and enables prognostic prediction in the Japanese population
【字体: 大 中 小 】 时间:2025年11月04日 来源:Nature Communications 15.7
编辑推荐:
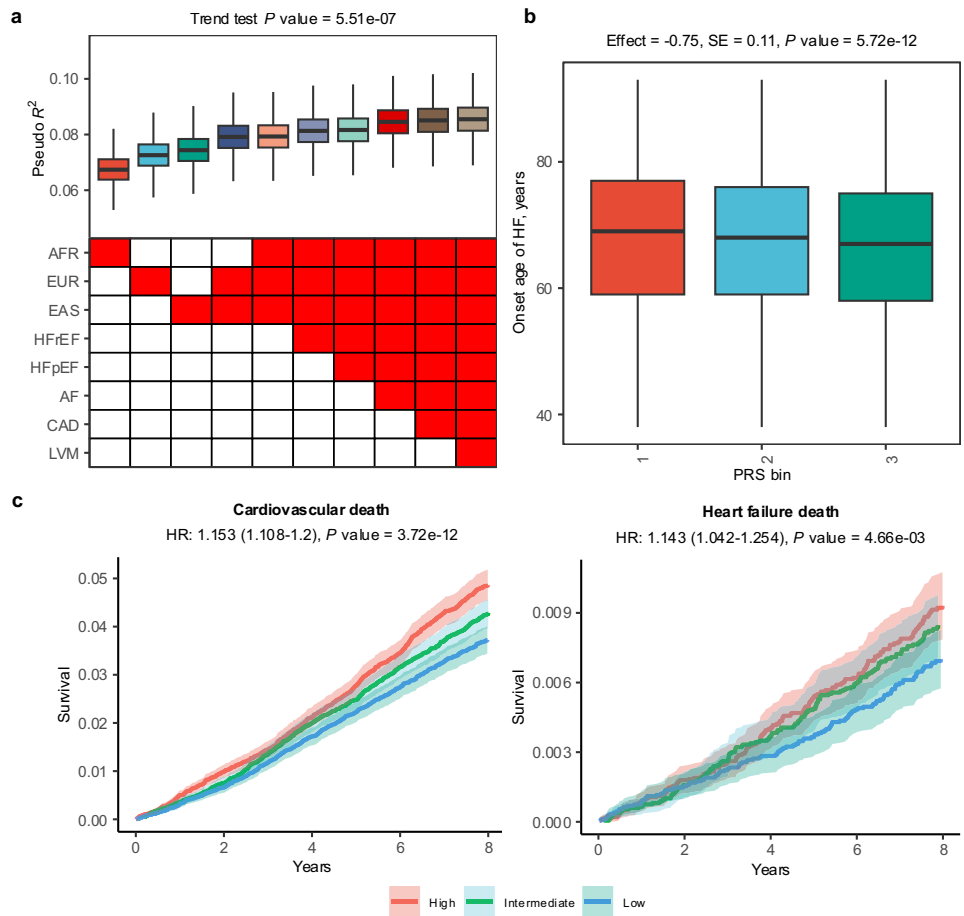
本研究针对心力衰竭(HF)遗传基础在非欧洲人群中认知不足的问题,开展了日本人群全基因组关联分析(GWAS),涵盖16,251例全因HF、4,254例射血分数降低型HF(HFrEF)、7,154例射血分数保留型HF(HFpEF)和11,122例非缺血性HF(NIHF)病例。研究鉴定出19个新位点,发现TTN常见变异(rs1484116)与心功能降低和长期死亡率恶化相关,并开发了跨祖先多基因风险评分(PRS)可预测早发HF和长期死亡风险。该成果发表于《Nature Communications》,为HF精准医疗奠定基础。





 生物通微信公众号
生物通微信公众号
知名企业招聘