
-

生物通官微
陪你抓住生命科技
跳动的脉搏
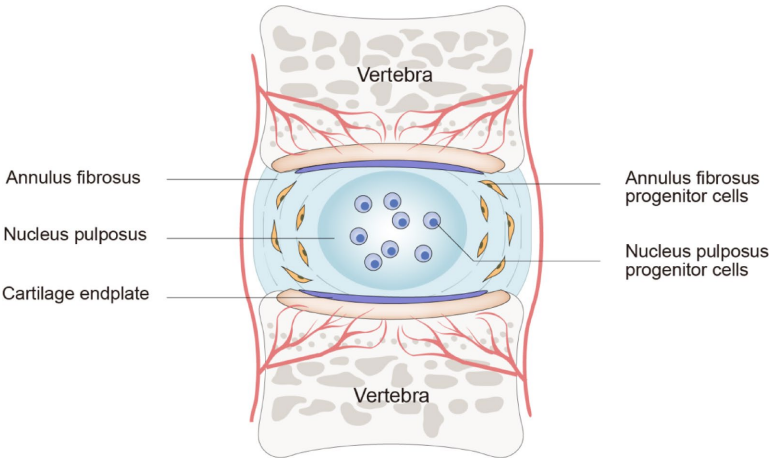
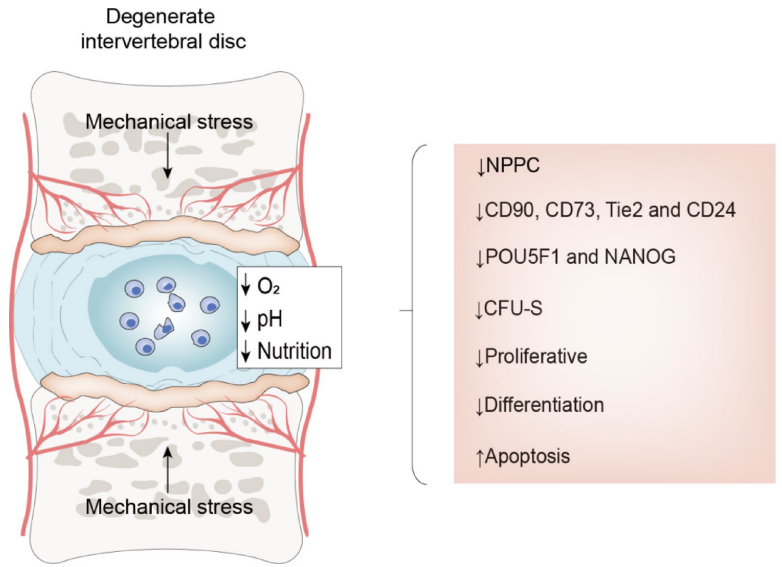
综述:髓核祖细胞在椎间盘退变和再生中的作用
《Journal of Orthopaedic Surgery and Research》:The role of nucleus pulposus progenitor cells in intervertebral disc degeneration and regeneration
【字体: 大 中 小 】 时间:2025年11月05日 来源:Journal of Orthopaedic Surgery and Research 2.8
编辑推荐:
本综述系统阐述了髓核祖细胞(NPPCs)在椎间盘退变(IDD)中的关键作用及再生治疗潜力。文章详细解析了NPPCs的细胞标志物(如Tie2、GD2、CD24)、多向分化能力(成软骨/成骨/成脂)及其调控通路(MEK/ERK、PI3K/Akt),指出通过靶向微环境(缺氧、酸性)和信号通路可增强NPPCs的再生功能,为开发细胞疗法(如干细胞移植、外泌体递送)提供了新策略。


 生物通微信公众号
生物通微信公众号
知名企业招聘