
-

生物通官微
陪你抓住生命科技
跳动的脉搏
综述:整合稳态应变与新兴技术研究复杂疾病
《Communications Biology》:Integrating allostasis and emerging technologies to study complex diseases
【字体: 大 中 小 】 时间:2025年11月07日 来源:Communications Biology 5.1
编辑推荐:
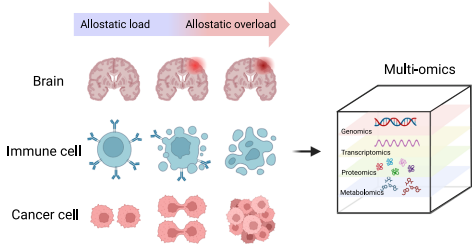
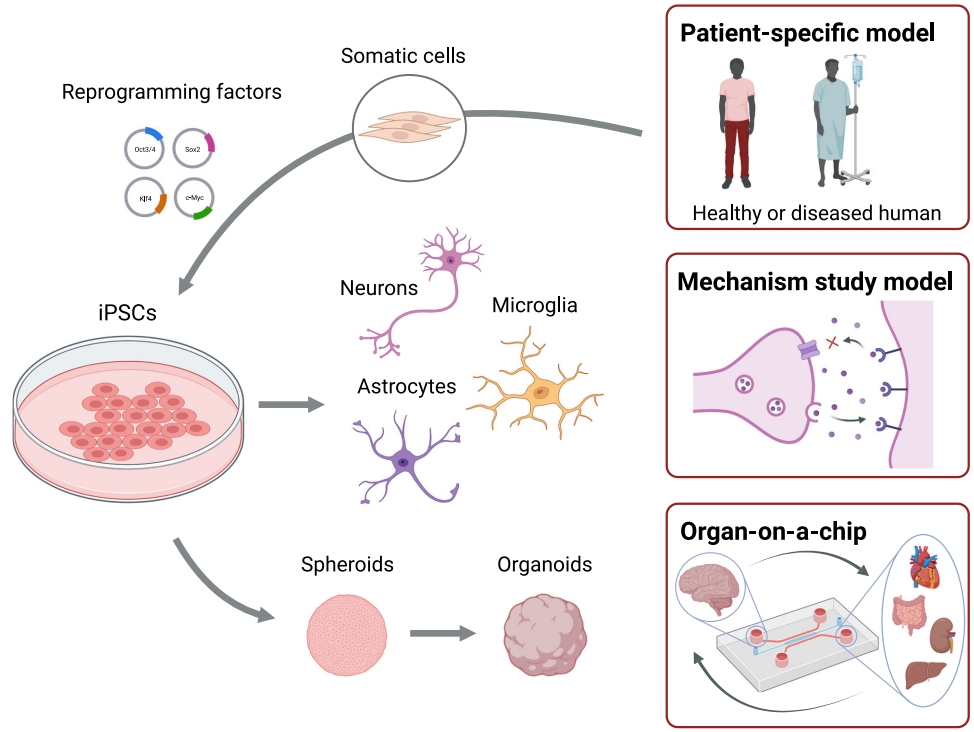
本综述系统阐述稳态应变(allostasis)框架如何为理解复杂疾病提供新视角,重点解析慢性压力通过神经内分泌(HPA/SAM轴)、免疫(CRP、IL-6、TNF-α)和代谢(血糖、BMI)等多系统交互作用累积生理负荷(allostatic load)的机制。文章强调多组学、iPSC类器官等前沿技术可动态揭示应激适应过程,为癌症、成瘾及Long COVID等疾病的精准诊疗提供新策略。
 生物通微信公众号
生物通微信公众号
知名企业招聘