
-

生物通官微
陪你抓住生命科技
跳动的脉搏
uN2CpolyG通过核滞留p65抑制NF-κB-NLRP3通路在神经元核内包涵体病中的机制研究
【字体: 大 中 小 】 时间:2025年02月10日 来源:Cell Communication and Signaling 8.2
编辑推荐:
本研究揭示了神经元核内包涵体病(NIID)中NOTCH2NLC基因CGG重复扩展翻译产物uN2CpolyG通过结合并滞留NF-κB关键蛋白p65于核内包涵体,导致NF-κB-NLRP3炎症通路抑制及自噬功能障碍的分子机制。研究人员通过单细胞测序、细胞模型和果蝇实验,证实激活NF-κB可减少uN2CpolyG聚集,为NIID等蛋白质聚集相关神经退行性疾病提供了新治疗靶点。
神经元核内包涵体病(NIID)是一种致命的神经退行性疾病,其特征是NOTCH2NLC基因5'非翻译区(5'UTR)的CGG重复异常扩展。这种扩展会翻译产生一种含有聚甘氨酸的毒性蛋白uN2CpolyG,该蛋白被认为是NIID的主要致病因子。临床上,一些NIID患者在脑病发作前会出现应激事件或感染触发,提示炎症可能在疾病发病机制中发挥作用,但其潜在分子机制尚不明确。
南昌大学第一附属医院神经内科的研究团队通过单细胞RNA测序发现,NIID患者皮肤组织中NFKBIA(编码NF-κB抑制蛋白IkBa)的表达显著降低。进一步研究发现,uN2CpolyG能够直接与NF-κB的核心蛋白p65相互作用,并将其滞留于核内包涵体中,导致p65磷酸化(p-p65)水平降低。这种滞留显著下调了NF-κB-NLRP3通路,损害了自噬功能,表现为LC3II/LC3I比值的下降。当用脂多糖(LPS)处理CGG100细胞时,p-p65、NLRP3和LC3II/LC3I水平显著增加,同时不溶性uN2CpolyG水平和核内包涵体数量减少。在果蝇敲入模型中,LPS显著减少了核内包涵体数量并改善了表型表现。
研究人员主要采用了以下关键技术方法:单细胞RNA测序分析NIID患者皮肤组织;构建含有不同长度CGG重复(9/69/100)的NOTCH2NLC cDNA质粒转染HEK-293T和U87-MG细胞模型;通过免疫共沉淀(Co-IP)和免疫荧光验证蛋白相互作用;建立CGG重复扩展的果蝇模型进行表型分析;使用LPS、姜黄素等药物干预评估NF-κB通路的影响。
研究结果部分:
NFKBIA转录水平在NIID组织中降低:单细胞测序显示NIID患者皮肤组织中NFKBIA表达显著下降,特别是在施万细胞中。
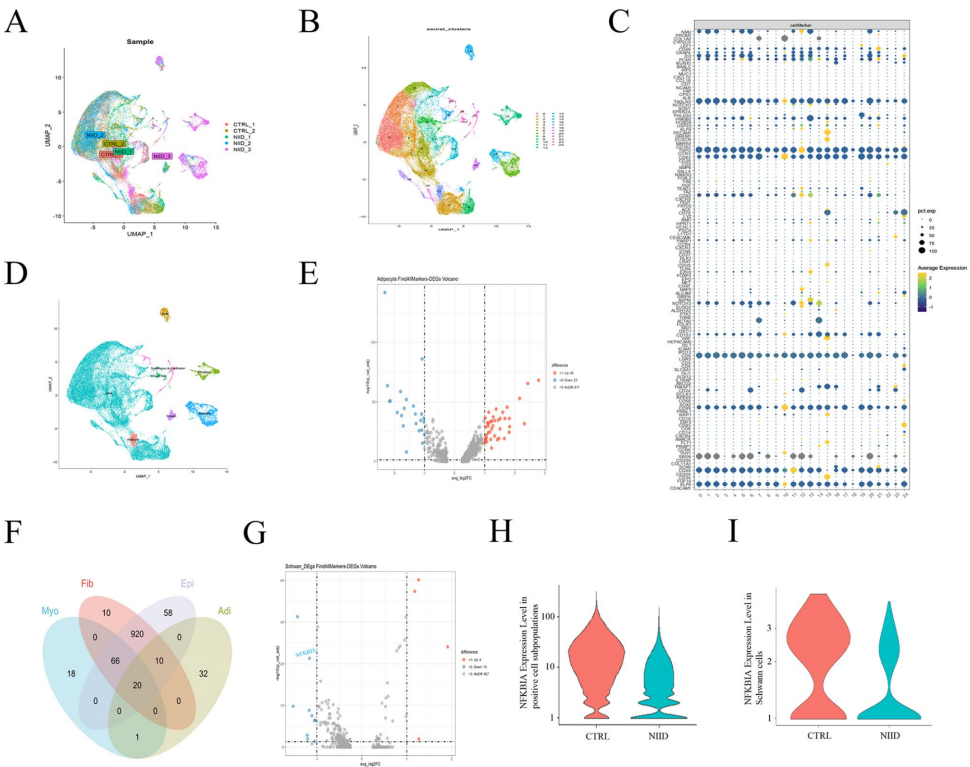
NIID细胞中IkBa蛋白水平降低:CGG100转染细胞显示IkBa蛋白水平显著降低,同时p-IkBa/IkBa比值增加。
p-p65核内水平降低抑制NF-κB通路:核质分离实验显示CGG100细胞核内p-p65水平显著降低,导致IL-1β、IL-6和TNF-α等炎症因子表达下降。
uN2CpolyG将p65招募至核内包涵体抑制其磷酸化:分子对接和Co-IP证实uN2CpolyG与p65直接相互作用,免疫荧光显示两者在核内共定位。
NF-κB活性降低通过抑制自噬加剧NIID表型:LPS处理可提高自噬标志物LC3II/LC3I比值并减少uN2CpolyG聚集,而自噬抑制剂3-MA逆转这一效果。
NLRP3导致NF-κB活性降低后自噬减少:CGG100细胞中NLRP3水平显著降低,LPS处理可同时上调NLRP3和自噬水平。
适度激活NF-κB改善果蝇NIID表型:100μM LPS处理显著提高果蝇运动能力并减少脑内包涵体数量。
这项研究首次阐明了uN2CpolyG通过"劫持"p65蛋白破坏NF-κB-NLRP3-自噬轴的新机制,不仅为理解NIID的发病机制提供了重要线索,也为其他由错误折叠蛋白聚集引起的神经退行性疾病(如阿尔茨海默病、帕金森病等)的治疗策略开发提供了新思路。特别是发现适度激活NF-κB通路可以促进毒性蛋白清除,这一发现可能开辟神经退行性疾病治疗的新途径。研究结果发表在《Cell Communication and Signaling》上,为开发针对蛋白质聚集疾病的精准治疗策略奠定了重要理论基础。
 生物通微信公众号
生物通微信公众号
知名企业招聘