
-

生物通官微
陪你抓住生命科技
跳动的脉搏
STING-PAR通路调控电离辐射诱导的细胞凋亡:从DNA损伤到胃肠道综合征治疗新靶点
【字体: 大 中 小 】 时间:2025年02月14日 来源:Cell Death & Differentiation 13.7
编辑推荐:
本研究揭示了STING(干扰素基因刺激因子)通过结合PARP1(聚ADP-核糖聚合酶-1)产生的PAR(聚ADP-核糖)链,在电离辐射(IR)诱导的细胞凋亡中发挥关键作用。研究人员发现STING缺失或PARP1抑制剂PJ34可显著降低辐射后肠道隐窝细胞死亡,提高小鼠生存率,为急性放射综合征(ARS)治疗提供了新策略。该成果发表于《Cell Death & Differentiation》,阐明了DNA损伤响应中STING的非经典功能。
在核事故或肿瘤放疗中,高剂量电离辐射(IR)会导致致命的胃肠道综合征(GIS),其核心机制是快速增殖的肠道隐窝细胞发生大规模凋亡。尽管已知DNA损伤是始动因素,但如何从分子层面解释辐射后细胞命运决定(修复或死亡)仍是未解之谜。中国科学院生物物理研究所和加州大学洛杉矶分校的研究团队通过跨学科合作,发现STING(stimulator of interferon genes)作为DNA损伤应答的关键调控因子,通过与PARP1生成的PAR(poly(ADP-ribose))直接结合,激活促凋亡通路,相关成果发表在《Cell Death & Differentiation》上。
研究采用腹部局部辐射(16.7Gy SBI)小鼠模型,结合骨髓来源巨噬细胞(BMDM)、THP-1单核细胞等多体系验证,通过免疫共沉淀、邻近连接技术(PLA)、线粒体分离等关键技术,系统解析了STING-PAR互作机制。
STING缺失提升辐射抗性
通过比较野生型与Stinggt-/gt-小鼠发现,STING缺陷使肠道绒毛高度保留更完整(152±62μm vs 65±9μm),隐窝丢失减少23%。电镜显示STING敲除细胞的线粒体形态保持完整,而野生型细胞出现明显凋亡特征。
PAR-STING互作驱动凋亡
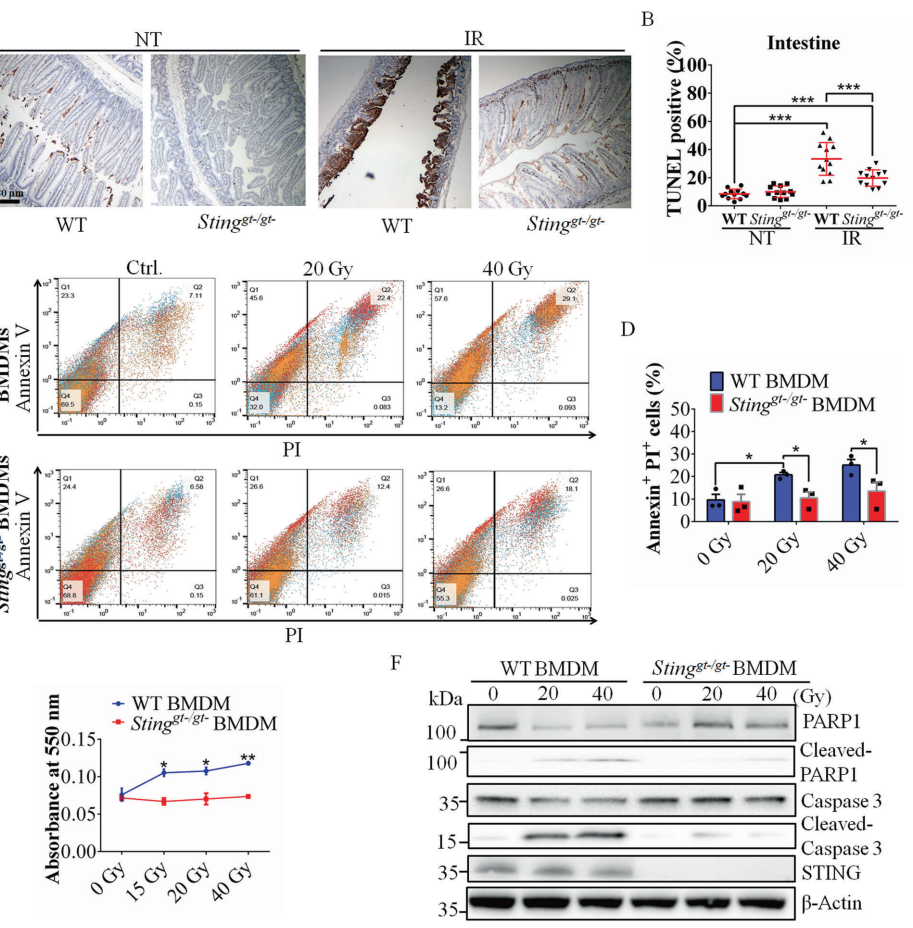
免疫共沉淀证实IR后STING与PAR特异性结合,PLA实验显示两者空间距离<40nm。体外实验证明带负电的PAR能改变STING电泳迁移率,200nM PAR处理3小时即可诱导STING磷酸化,该过程不依赖cGAS。
精准调控PARP1的治疗价值
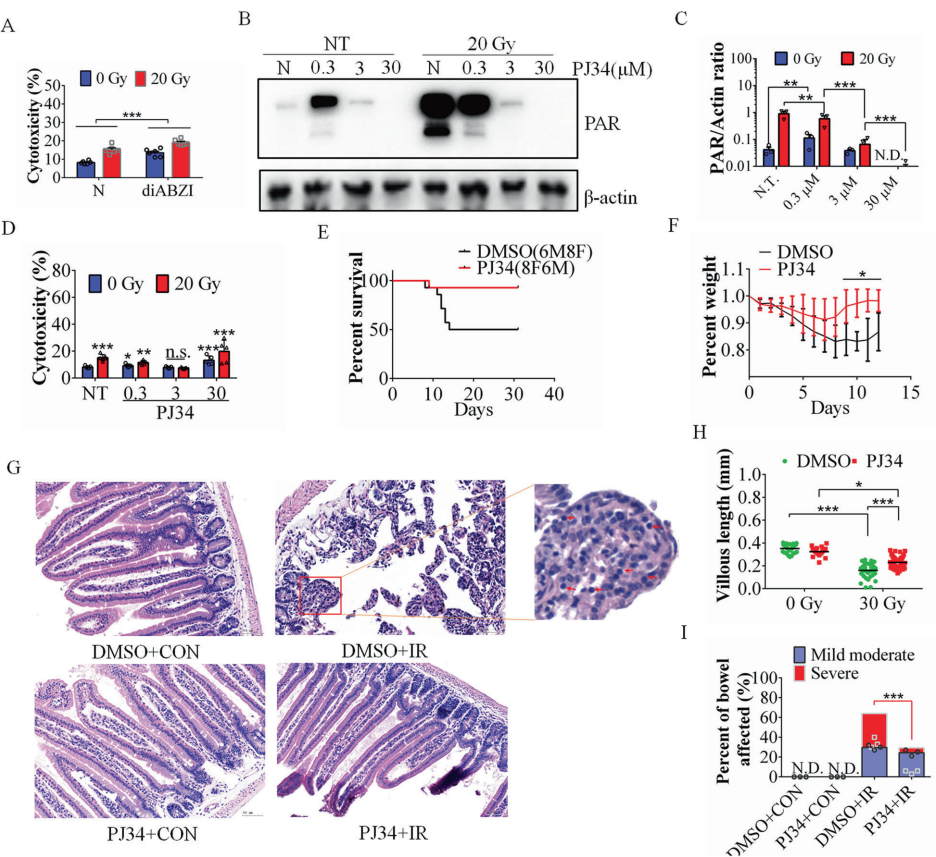
低剂量PARP1抑制剂PJ34(3μM)使小鼠生存率从50%提升至93%,维持LGR5+肠道干细胞存活。机制上,PJ34通过抑制PAR过量产生,阻断STING-PAR互作,下调促凋亡因子PUMA表达,减少Bax向线粒体外膜转位。
非经典信号通路激活
STING磷酸化不仅激活TBK1-IRF3通路,还通过NF-κB上调PUMA表达。有趣的是,STING缺失虽降低IFN-β和IP10表达,但Takemura等研究证实I型干扰素缺失不影响辐射抗性,提示STING促凋亡作用独立于干扰素应答。
该研究首次揭示PAR-STING轴是决定辐射后细胞命运的关键开关:正常PAR水平促进DNA修复,过量PAR则通过STING触发凋亡。这一发现为急性放射损伤提供了"双刃剑"式治疗策略——完全抑制PARP1可用于肿瘤增敏,而精准调控PAR水平则可保护正常组织。在转化医学层面,STING激动剂diABZI与放疗联用可增强抗肿瘤效果,而临时性STING抑制或成为核应急医学的新选择。
研究创新性地将DNA损伤修复、先天免疫应答和细胞凋亡三大领域联系起来,为理解辐射生物学效应提供了全新视角。后续研究可进一步探索不同辐射剂量下PAR-STING通路的动态变化,以及该通路与p53等其他DNA损伤应答因子的交叉调控关系。
 生物通微信公众号
生物通微信公众号
知名企业招聘