
-

生物通官微
陪你抓住生命科技
跳动的脉搏
单细胞技术赋能三项大规模研究:深度解码患者样本
【字体: 大 中 小 】 时间:2025年05月14日 来源:10x Genomics
编辑推荐:
在这篇文章中,我们将探讨几项有影响力的大规模研究,这些研究利用我们的技术来揭示健康和疾病方面的新见解。这些论文展示了scRNA-seq在大型项目中的突破性潜力,包括细胞图谱绘制、大型队列研究、治疗监测和生物标志物筛选。
生物学中一些最紧迫的问题是无法用小型数据集来回答的,比如肿瘤如何演化,以及为什么某些疗法只对部分患者有效。越来越多的研究人员正使用数百个样本的数百万个细胞来开展大规模单细胞分析,以取得突破性发现。
当然,强大的单细胞分析能力也伴随着巨大的数据复杂性。减少批次效应并确保样本质量的一致性并非易事。不过,我们的单细胞解决方案正是为克服这些障碍而设计的,为您获得有影响力的见解扫清了道路。
我们久经考验的仪器支持的工作流程具有高重复性和可靠性能,无论有多少样本、用户或分析地点,都能确保不同运行和时间点的数据质量保持一致。此外,凭借新开发的分析功能(如先进的多重分析能力),我们正在不断降低成本,让大规模单细胞研究比以往任何时候都更容易实现。
在这篇文章中,我们将探讨几项有影响力的大规模研究,这些研究利用我们的技术来揭示健康和疾病方面的新见解。这些论文展示了scRNA-seq在大型项目中的突破性潜力,包括细胞图谱绘制、大型队列研究、治疗监测和生物标志物筛选。
 研究一
研究一
大型患者队列的多组学分析揭示了重症疾病的特征
为了解哪些免疫反应导致COVID-19患者的结局不同,研究人员分析了从130名感染患者的血液样本中采集的78万个免疫细胞,绘制了一份详细的图谱来说明免疫细胞对SARS-CoV-2感染有何反应,有时是过度反应(1)。这项开创性的研究发表在《Nature Medicine》杂志上,它采用我们的通用型5’ 基因表达分析来捕获转录组数据和免疫受体序列,最终描绘了适应性免疫细胞(如T细胞和B细胞)如何协调抗病毒防御并促成炎症,而炎症在重症病例中往往不受控制。
通过将单细胞功能整合到传统免疫学工具的下游,研究团队达到了流式分选等传统方法无法比拟的分辨率水平和可扩展性。这些方法还大大提高了成本效益,因为在这种规模下,传统工作流程的成本要高得多。
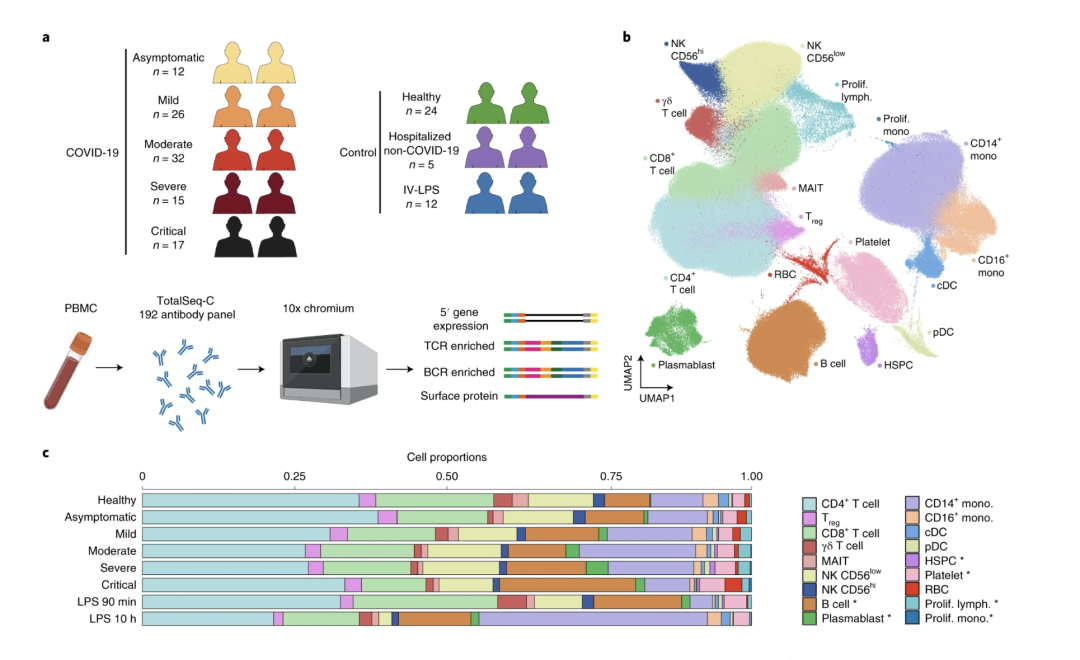
图1. 对采集自健康个体和感染患者的PBMC样本的多组学分析揭示了与疾病严重程度相关的不同免疫细胞群体。(A) 研究参与者以及采集的样本和数据概览。图片采用BioRender.com绘制。(B) 质控后所有781,123个细胞的UMAP图。图中显示了基于5’ 基因表达的Leiden聚类,并按照细胞类型着色。lymph:淋巴细胞;mono:单核细胞;prolif:增殖中的。(C) b图所示的细胞类型比例的条形图,按疾病状况和COVID-19严重程度分开。图片来源:Stephenson等人论文中的图1A-C (1)。CC BY 4.0.
利用久经考验的Chromium单细胞解决方案分析100多份患者样本中的近百万个细胞,这确保研究人员不会忽略任何罕见的细胞类型,并且能够对不同患者群体(包括疾病严重程度不同和患者人口统计学特征不同)进行有意义的比较。他们鉴定出与轻症和重症相关的T细胞和B细胞克隆。
这种大规模研究,再加上通用型5’ 基因表达分析无与伦比的灵敏度,揭示了一个罕见的免疫细胞亚群,也就是集中在重症病例中的超活化单核细胞,它们与细胞因子风暴这种可能危及生命的过度免疫反应相关。这个罕见的细胞亚群也许能够成为COVID-19重症病例的治疗靶点或生物标志物。
 研究二
研究二
对100多万个细胞的单细胞分析揭示了疾病严重程度的生物标志物
在这项研究中,宾夕法尼亚大学的研究人员利用我们超灵敏的通用型3’ 基因表达分析来探讨一个类似的问题——COVID-19患者的免疫失调对疾病严重程度有何贡献。最终,他们试图通过鉴定潜在的生物标志物和靶点来指导未来的治疗策略,从而对患者产生重大影响(2)。
研究人员大胆尝试,对100多名COVID-19住院患者的100多万个细胞进行分析,目前这项成果发表在《Science》杂志上。他们选择分析各种类型的样本,包括PBMC、鼻咽拭子和支气管肺泡灌洗液。
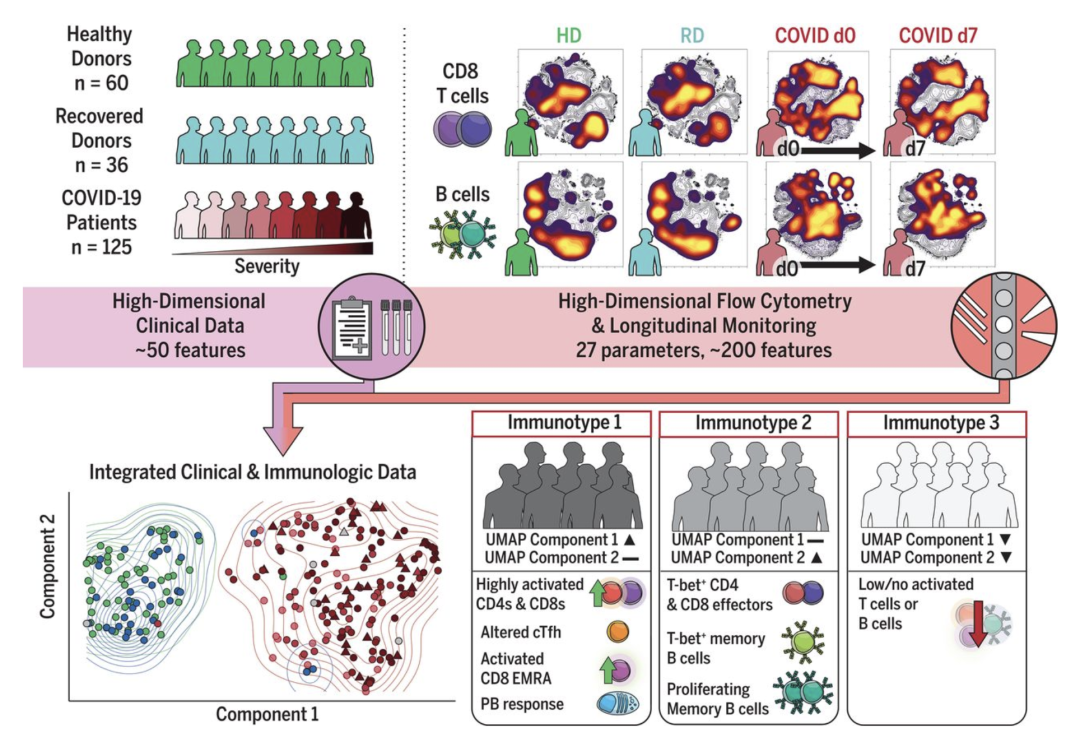
图2. 对COVID-19患者的高维免疫反应分析鉴定出三种免疫型(immunotype)。收集60名健康供体(HD)、36名康复供体(RD)和125名COVID-19住院患者的外周血单核细胞免疫分析数据和临床数据。高维流式细胞术和纵向分析突出了反应的稳定性和波动性。UMAP可视化将约200个免疫特征提炼为两个维度,并鉴定出与临床结局相关的三种免疫型。cTfh:循环滤泡辅助T细胞;EMRA:重新表达CD45RA的效应记忆T细胞亚群;d0:第0天。图片来源:Matthew等人论文中的图文摘要(2)。CC BY 4.0.
我们灵活的工作流程支持最广泛的样本类型,因此研究人员在进行高通量处理的同时还能在数百个样本中获得一致的灵敏度,不仅能够确保数据质量可靠,还能尽量减少批次效应。这使得研究人员能够发现罕见的细胞群,并自信地将免疫细胞行为与疾病严重程度相关联。
最终,作者发现了不同的细胞动态,它们驱动了COVID-19重症和轻症患者的免疫反应。他们的分析表明,过度活化的单核细胞引发了在COVID-19重症病例中经常出现的有害细胞因子风暴。在重症患者的一些样本中,他们鉴定出一群耗竭的T细胞,这些细胞破坏了免疫反应。相反,他们在病情较轻的患者中观察到强大的T细胞活性,阐明了保护性免疫机制。
研究人员利用强大的数据整合策略确定了与治疗相关的免疫标志物,可预测COVID-19的严重程度和结局。每名患者的单细胞数据都标注有详细的临床元数据,包括疾病严重程度(轻度、中度或重度)、人口统计学特征、治疗方案以及细胞因子水平等关键标志物。通过将细胞转录图谱与临床元数据相关联,他们可以确定与疾病进展和结局相关的免疫细胞状态和转录变化。
这项研究通过将高维scRNA-seq数据与临床指标相关联,填补了分子信息与患者结局之间的空白。他们确定了驱动严重疾病的免疫失调模式,为后续开发靶向疗法和诊断标志物的研究提供了路线图。
 研究三
研究三
纵向研究通过scRNA-seq揭示了治疗结局背后的驱动因素
洛桑大学和洛桑大学医院的研究人员采用单细胞技术解决了一个重要难题:纵向揭示接受过继细胞疗法(ACT)的癌症患者的免疫动态(3)。
研究人员采集了13名转移性黑色素瘤患者的样本,这些患者在一项1期临床研究(NCT03475134)中接受了肿瘤浸润淋巴细胞的过继细胞疗法(TIL-ACT)。他们在几个关键时间点采集样本:筛查时(如果可行)、手术时、TIL-ACT治疗后至少30天、接受nivolumab治疗4周后(如果适用,可选)以及疾病进展期间(可选)。
随后,他们利用通用型3’基因表达分析、批量细胞RNA-seq和空间蛋白质组学来分析采集的样本,以便揭开应答者治疗成功和无应答者治疗耐药背后的机制。对患者进行三年多的跟踪研究,可以全面了解肿瘤微环境(TME)如何随治疗而演化。
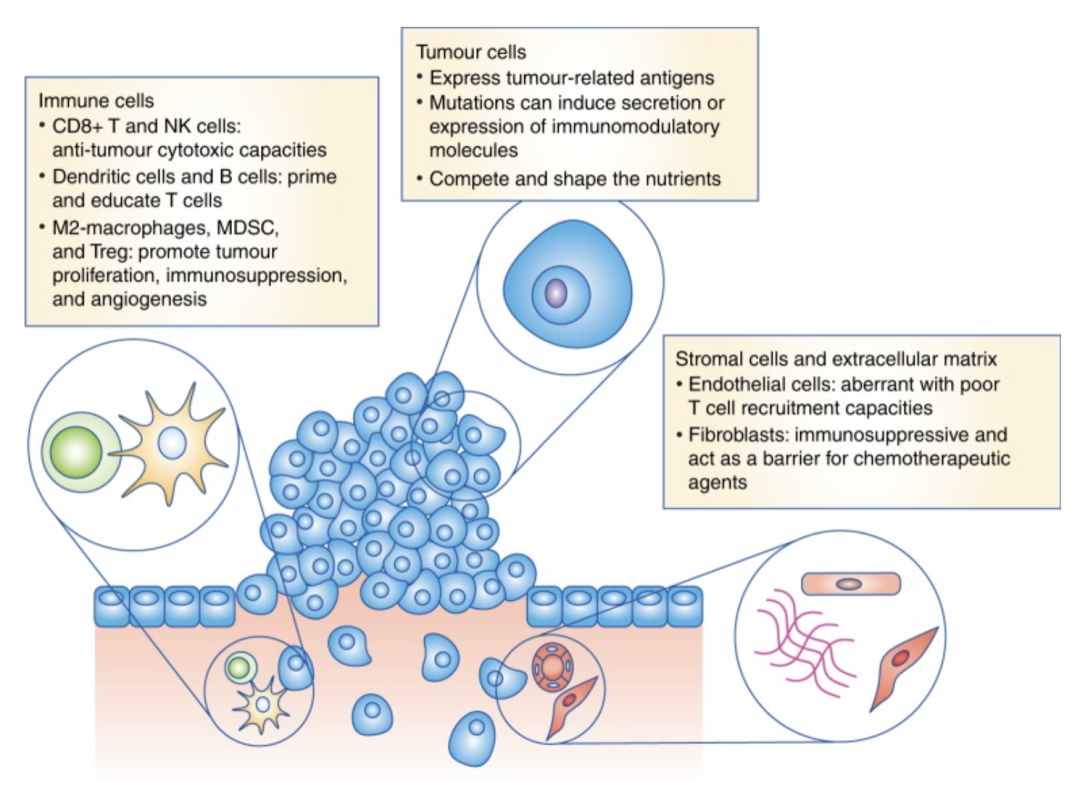
图3. TME的高层次概览图。描述肿瘤微环境中三个主要组成部分的示意图。图中突出显示了塑造免疫细胞结构的机制。MDSC:髓系来源的抑制细胞;Treg:调节性CD4+ T细胞。图片来源:Giraldo等人论文中的图1 (4)。CC BY 4.0.
尽管批量细胞RNA-seq提供了基因表达的总体概况,空间蛋白质组学定位了免疫细胞在TME中的相互作用,但研究的结论取决于单细胞分析获得的精细见解。具体来说,研究人员发现,应答者具有预先存在的免疫生态位(由肿瘤反应性CD8+ T细胞和CXCL9+巨噬细胞组成),富含抗肿瘤免疫所必需的共刺激和抗原呈递信号。单细胞数据揭示了驱动这些相互作用的转录程序,并鉴定出罕见且功能独特的免疫亚群,而单靠批量分析和空间方法无法获得这些见解。
纵向设计进一步证明了Chromium单细胞解决方案在追踪免疫特征演化方面有多出色。有了通用型3’基因表达分析,研究人员能够监测治疗如何重编程应答者的TME,重建抗肿瘤免疫网络,并重塑巨噬细胞状态以维持CD8+ T细胞活性。
相比之下,无应答者缺乏这些支持性的免疫相互作用,导致治疗效果不佳。如果没有单细胞分辨率,这项研究就无法将空间富集的免疫细胞与其功能作用相关联,也无法确定关键的生物标志物,如CD8+ TIL与巨噬细胞的相互作用,从而预测治疗的成功率。
这些成果凸显了单细胞技术对于在纵向研究中解析复杂免疫机制是不可或缺的。通过提供追踪不同患者和不同时间点的免疫动态所需的分辨率和扩展性,研究人员发现了可操作的见解,有望改善患者选择和优化免疫治疗策略,为更有效的癌症治疗铺平了道路。
利用单细胞创新推进大规模研究
本文重点介绍的研究仅仅代表了几个例子,说明了研究人员如何将Chromium单细胞分析无缝整合到他们的高通量研究中来分析不同患者、时间点和机构的样本,并获得令人难以置信的见解。
目前,研究人员也在与我们合作,利用我们2024年初发布的最先进的单细胞技术(GEM-X)开展宏大的研究。这项技术将我们的可靠性能提升到一个全新水平,具体介绍请看这里。
例如,加文医学研究所将在TenK10K项目中使用我们的通用型3’基因表达分析,该项目旨在分析一万名个体的5,000万个人类细胞,以确定与自身免疫疾病和癌症等复杂疾病相关的独特转录特征(5,6)。
随着我们通过高性价比的解决方案扩大了使用范围,通过大规模多重分析增加了起始量,并扩展了自动化支持,我们迫不及待地想看到更多的研究人员将如何使用GEM-X单细胞分析带来的高质量单细胞数据。
了解我们新产品的更多信息,访问我们全新的大项目页面(7),与我们的专家联系,看看单细胞分析将如何提升您下一个宏大项目的影响力。
欢迎扫码联系我们询价或了解更多技术信息

参考资源:
1. Lieberman J, et al. Multiomic analysis of a large cohort of COVID-19 patients reveals signatures of severe disease. Nature Medicine 27: 1340–1355 (2021). doi: 10.1038/s41591-021-01329-2
2. Zhang H, et al. Immune dysregulation and therapeutic targets in severe COVID-19: Insights from single-cell analysis. Science 375: 314–321 (2021). doi: 10.1126/science.abc8511
3. Barras D, et al. Response to tumor-infiltrating lymphocyte adoptive therapy is associated with preexisting CD8+ T-myeloid cell networks in melanoma. Science Immunology 9: eadg7995 (2024). doi: 10.1126/sciimmunol.adg7995
4. Giraldo N, et al. The clinical role of the TME in solid cancer. Br J Cancer 120: 45–53 (2019). doi: 10.1038/s41416-018-0327-z
5. 10x Genomics. 10x Genomics Technology Supports TenK10K Project Led by Garvan Institute of Medical Research to Help Transform the Treatment of Complex Diseases. News Release. August 2024. Available at: https://investors.10xgenomics.com/news/news-details/2024/10x-Genomics-Technology-Supports-TenK10K-Project-Led-by-Garvan-Institute-of-Medical-Research-to-Help-Transform-the-Treatment-of-Complex-Diseases/default.aspx
6. D’Urso M, et al. Single-cell eQTL mapping identifies cell type–specific genetic control of autoimmune disease. Science 376: 555–562 (2024). doi: 10.1126/science.abf3041
7. https://pages.10xgenomics.com/web-2024-11-contact-request-chr-scge-brand-phase-3-large-projects_lp.html