
-

生物通官微
陪你抓住生命科技
跳动的脉搏
头颈鳞状细胞癌(HNSCC)个体化治疗评估:功能基因组学与多组学整合研究新策略
【字体: 大 中 小 】 时间:2025年06月06日 来源:Scientific Reports 3.8
编辑推荐:
本研究针对头颈鳞状细胞癌(HNSCC)治疗选择有限的临床困境,通过整合高通量抑制剂筛选与多组学数据,构建了20例患者来源肿瘤细胞模型的功能基因组学图谱。研究人员开发了HNSCC特异性抑制剂面板,结合全外显子测序(WES)、RNA测序和拷贝数变异(CNA)分析,揭示了EGFR、PD-1等靶点的响应模式,并创新性提出"响应卡片"(Response Cards)可视化分析工具,为肿瘤委员会决策提供了精准医疗新范式。
头颈鳞状细胞癌(HNSCC)作为全球第七大常见恶性肿瘤,每年导致数万人死亡,其治疗面临严峻挑战。尽管手术、放疗和化疗构成标准治疗方案,但患者常遭遇严重的功能损害和生活质量下降。更棘手的是,目前FDA仅批准了三种靶向药物——抗EGFR(表皮生长因子受体)的单抗西妥昔单抗(cetuximab)和两种PD-1(程序性死亡受体1)抑制剂帕博利珠单抗(pembrolizumab)与纳武利尤单抗(nivolumab),且这些药物仅对部分患者有效。肿瘤的高度异质性和缺乏可靠的预测生物标志物,使得临床医生在制定个性化治疗方案时举步维艰。
为破解这一难题,俄勒冈健康与科学大学Knight癌症研究所的Daniel Bottomly和Chase Mathieson领衔的研究团队开展了一项开创性研究。研究人员将白血病研究中成功应用的高通量功能筛选技术移植到HNSCC领域,通过对20例手术患者的新鲜肿瘤样本建立原代细胞模型,整合基因组学分析与药物敏感性测试,绘制了首个HNSCC患者特异性功能基因组学图谱。这项发表于《Scientific Reports》的研究,为实现HNSCC精准医疗提供了重要方法论框架和临床决策工具。
研究团队采用多组学联用策略:从20例原发/复发HNSCC患者获取肿瘤组织建立低传代(P1-P2)原代细胞模型,通过Affymetrix CytoScan HD芯片进行拷贝数分析,Illumina HiSeq 2500平台完成全外显子测序和RNA测序,同时采用反相蛋白阵列(RPPA)检测蛋白质表达。功能层面,研究人员设计了包含89种单药和49种组合的抑制剂面板,通过72小时MTS法测定药物敏感性。数据分析采用加权基因共表达网络分析(WGCNA)和自主开发的网络传播算法,最终通过"响应卡片"实现数据可视化整合。
临床和基因组学特征
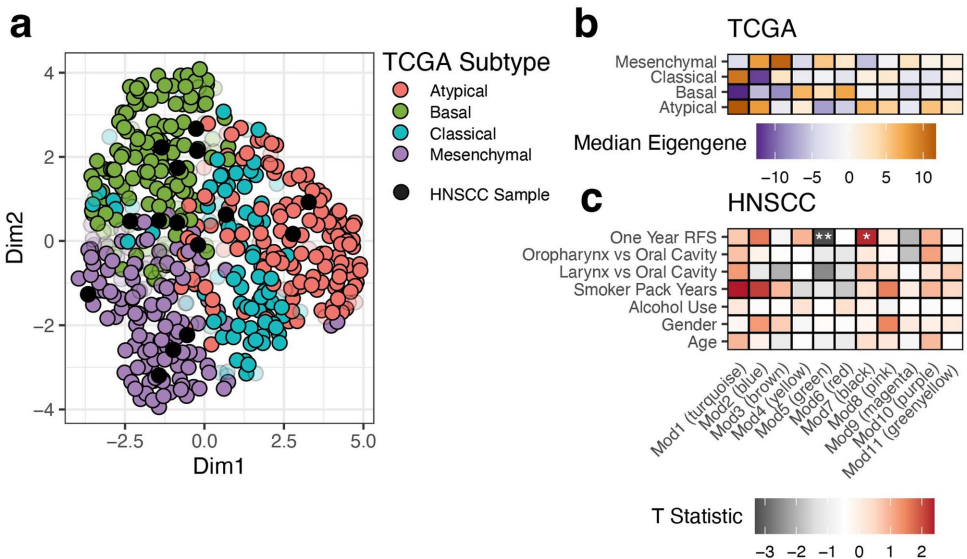
研究队列包含14例原发和6例复发HNSCC患者,解剖部位涵盖口腔(12例)、喉部(4例)和口咽部(3例)。与TCGA-HNSC数据库对比显示,TP53(53%)、NOTCH1(11%)等驱动基因突变频率高度一致。RNA测序将患者分为典型性、基底样、间质型和经典型四种分子亚型,其中HPV阳性病例均归类为典型性亚型,验证了既往发现的生物学特征。
比较分析与TCGA-HNSC
全外显子测序数据显示,研究队列重现了TCGA报告的11个显著突变基因中的8个,其中TP53和NOTCH1突变频率差异仅1%。拷贝数分析发现CDKN2A缺失频率(25%)与TCGA(28%)接近,但总体驱动性CNA频率高于TCGA队列,可能与检测平台差异有关。
表达亚型分析
通过643个特征基因将患者分为四类表达亚型,其中Mod3(棕色)模块在间质型中高表达,显著富集上皮-间质转化(EMT)特征。Mod5(绿色)和Mod7(黑色)模块的表达量与一年无复发生存(RFS)显著相关,其中INHBA基因作为Mod5核心基因,其高表达与HNSCC不良预后相关。
肿瘤细胞模型建立
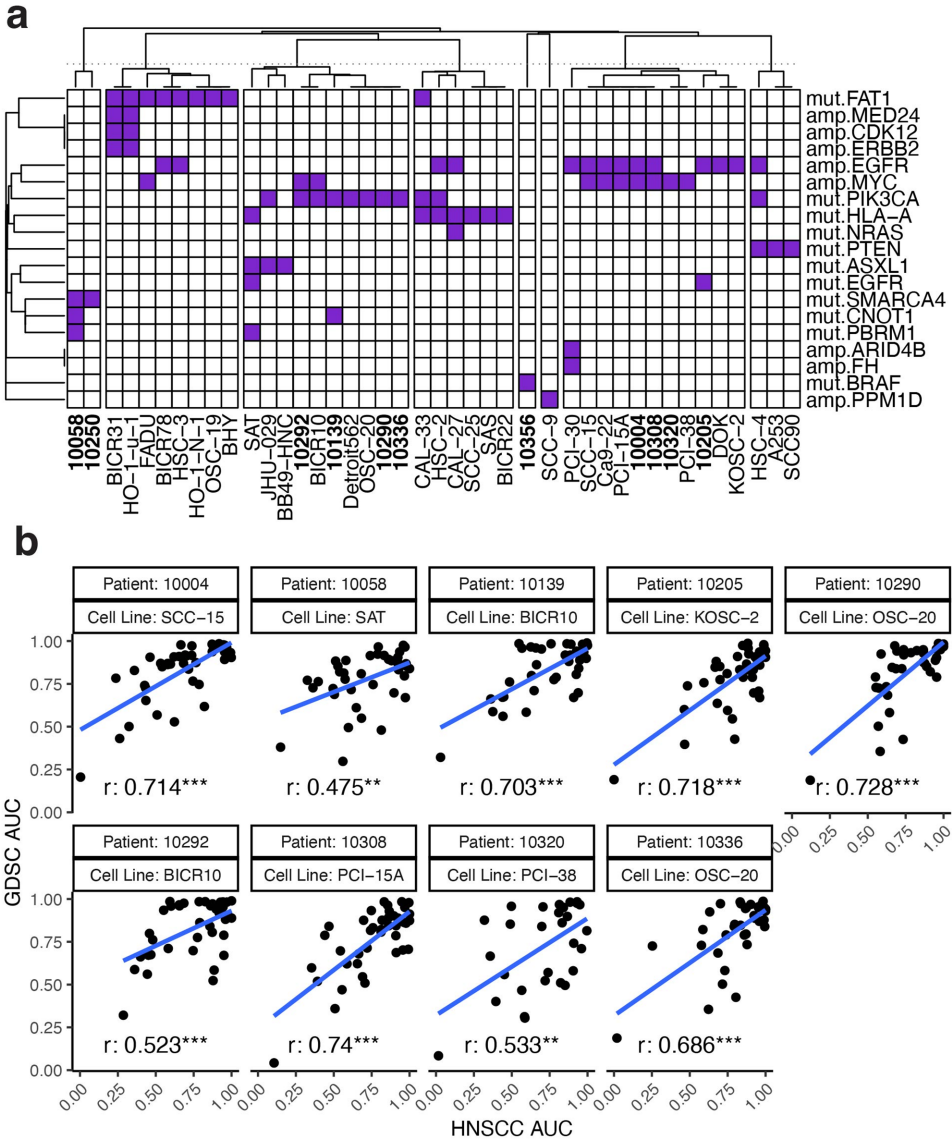
从90例尝试中成功建立20例上皮源性细胞系,免疫荧光证实其保持角蛋白表达且成纤维细胞污染<5%。三例细胞系(10336、10021、10356)显示部分间质特征,但未完全丧失上皮标记物,与原始肿瘤的鳞癌病理诊断一致。
抑制剂检测分析
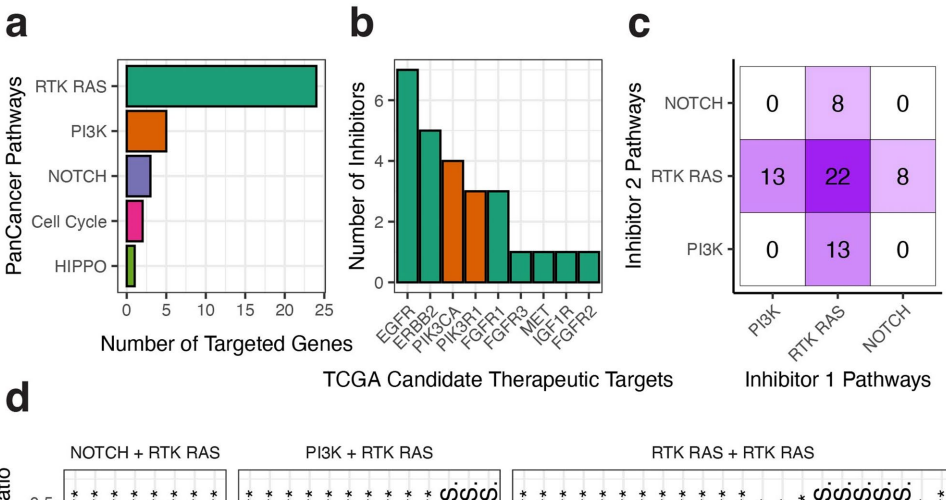
抑制剂面板覆盖了PanCancer RTK-RAS通路中9个TCGA推荐的候选靶点。31种药物组合显示出显著协同效应(配对t检验P<0.001),如EGFR抑制剂与MEK抑制剂的联合使用。与GDSC数据库比较显示,7/9匹配患者样本的药物响应谱与对应细胞系显著相关(Pearson相关系数>0.8, P<0.001)。
药物响应探索
创新性开发的"基因评分"系统识别出EGFR扩增患者对EGFR抑制剂异常敏感。典型案例10058号患者虽无EGFR基因改变,但通过网络传播算法发现7个EGFR/ERBB家族邻近基因突变可能介导药物敏感性。
讨论与结论
该研究首次在HNSCC领域实现了患者来源模型的功能基因组学整合分析,突破了传统细胞系研究的局限性。通过建立包含基因组变异、表达亚型和药物敏感性的多维数据集,研究人员证实了原代细胞模型在重现临床药物响应方面的可靠性。创新性开发的"响应卡片"工具将复杂数据转化为可视化临床决策支持系统,使肿瘤委员会能直观评估靶向治疗策略。
研究揭示了几个关键发现:(1)HNSCC的分子异质性需要功能验证来补充基因组数据;(2)网络传播算法能有效识别间接基因-药物关联;(3)早期传代细胞模型(P1-P2)可最大限度保留肿瘤原始特性。这些发现为即将开展的SMMART临床试验提供了方法论基础,也为其他实体瘤的精准医疗研究树立了范式。
局限性在于样本量较小和缺乏体内模型验证,未来或可通过植入式微装置进行术前药敏测试来弥补。该研究的重要意义在于搭建了从实验室到临床的转化桥梁,其整合分析框架可扩展至更大队列,最终实现HNSCC治疗的真正个体化。
 生物通微信公众号
生物通微信公众号
知名企业招聘