
-

生物通官微
陪你抓住生命科技
跳动的脉搏
综述 | 上皮-间质转化与癌症转移:实验模型与方法研究现状
【字体: 大 中 小 】 时间:2025年06月08日 来源:Molecular Cancer 27.7
编辑推荐:
这篇综述全面梳理了上皮-间质转化(EMT)和癌症转移研究领域的最新实验模型与方法,重点探讨了从经典迁移/侵袭实验到前沿空间组学技术的多层次研究策略,特别强调了尿激酶受体(u-PAR)、基质金属蛋白酶(MMP)等关键分子在转移级联中的作用。
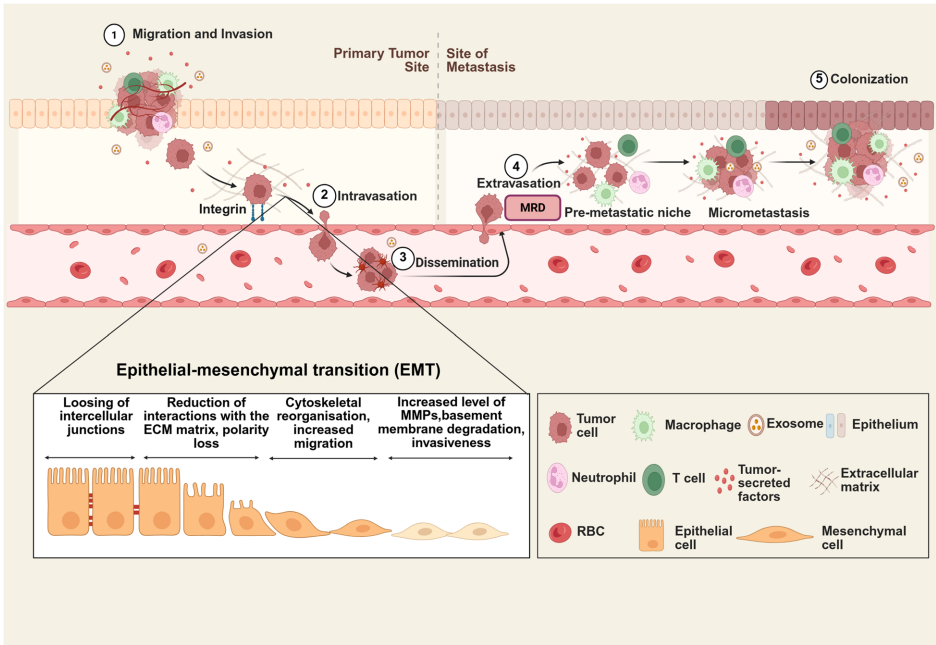
上皮-间质转化(EMT)是胚胎发育、伤口愈合和癌症进展中的重要过程。EMT在癌症转移中发挥核心作用,触发肿瘤发生和干性,并激活转移级联反应,导致治疗耐药性。
近日,印度卡林加工业技术学院(KIIT)和德国海德堡大学的研究人员总结了目前在体外和体内研究EMT和转移的实验模型现状,旨在为计划进入该领域的研究人员提供参考。这篇综述于6月7日发表在《Molecular Cancer》杂志上。
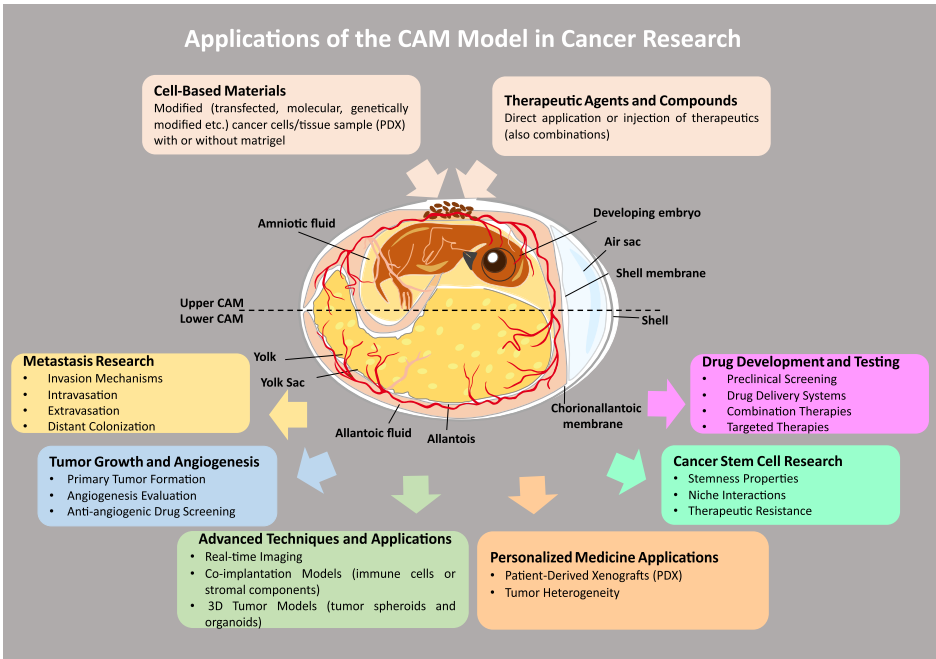
文章强调了理解EMT功能和转移主要步骤的方法,包括迁移、侵袭和基质降解实验、微流控技术、3D共培养模型、球状体、类器官及最新的空间和成像方法。体内模型被视为分析细胞内渗、位点转移和治疗应答的有力工具,包括绒毛尿囊膜(CAM)实验、异种移植模型以及转基因和人源化小鼠等。
经典功能实验方法
划痕实验和Transwell迁移实验仍是研究EMT的基础工具。在优化实验中,使用丝裂霉素C处理可消除增殖干扰,而ATP检测法比传统结晶紫染色灵敏度提高100倍。明胶酶谱分析能检测低至10 pg的MMP-2活性,揭示u-PA/u-PAR系统通过激活纤溶酶原促进ECM降解的机制。创新的层粘连蛋白降解实验采用放射性标记定量受体结合型u-PA的特异性降解能力,为基底膜侵袭研究提供分子层面证据。
微环境互作模型
3D共培养系统证实间充质干细胞(MSC)通过TGF-β1/ZEB/miR-200通路诱导乳腺癌细胞EMT。患者来源类器官(PDO)保留原发肿瘤异质性,如结直肠癌类器官在添加TGF-β抑制剂(A83-01)和R-spondin1的培养基中可模拟腺瘤-癌转变过程。空间转录组技术突破性地绘制了肿瘤微环境中上皮-间质混合表型的区域分布,发现IL-6/IL-8阳性炎症样癌相关成纤维细胞(iCAF)富集区与EMT标志物表达显著相关。
转移级联研究平台
鸡胚绒毛尿囊膜(CAM)模型凭借ALU-YB8亚家族TaqMan-PCR技术,可定量检测低至10个 intravasation的肿瘤细胞,其PDX移植成功率高达90%。该模型揭示u-PAR通过整合素相互作用调控肿瘤细胞休眠-增殖转换,为微残留病灶(MRD)研究提供关键线索。微流控器官芯片模拟血脑屏障外渗过程,发现缺氧预处理使乳腺癌细胞外渗率提升3倍,与临床转移倾向高度吻合。
前沿检测技术
单细胞EPIDROP技术区分上皮型(EpCAM+)和间质型(EpCAM-)循环肿瘤细胞(CTC),而质谱流式可同时检测单个CTC中驱动基因突变与药物靶点表达。线粒体-核交换(MNX)小鼠模型证明mtDNA单倍型通过活性氧(ROS)调控转移器官趋向性,为"种子-土壤"学说提供新证据。
治疗转化潜力
脑转移类器官与免疫细胞共培养系统显示,CDK4/6抑制剂abemaciclib可突破palbociclib耐药屏障。针对EMT-免疫抑制关联,HER2+胃癌PDX模型证实曲妥珠单抗耐药与YAP1介导的EMT程序激活相关,而靶向SRRM4-REST剪切变体可阻断肺癌脑转移。这些发现为开发针对转移生态位的联合疗法提供了精准工具。
 生物通微信公众号
生物通微信公众号
知名企业招聘