
-

生物通官微
陪你抓住生命科技
跳动的脉搏
人脐带间充质干细胞外泌体通过let-7a-5p/AMPK/mTOR轴改善POI大鼠卵泡间质细胞自噬的研究
【字体: 大 中 小 】 时间:2025年06月08日 来源:Stem Cell Research & Therapy 7.1
编辑推荐:
本研究针对早发性卵巢功能不全(POI)导致的不孕问题,由滨州医学院团队通过hUMSC-Exos干预,首次揭示了let-7a-5p通过靶向AMPK/mTOR通路抑制卵泡膜间质细胞(TICs)自噬的治疗机制。实验证实hUMSC-Exos能显著改善CTX诱导的卵巢形态和功能损伤,为POI临床治疗提供了新靶点。
在女性生殖健康领域,早发性卵巢功能不全(Premature Ovarian Insufficiency, POI)犹如一记沉重的警钟,影响着1-3%的育龄女性。这种疾病不仅导致月经紊乱和不孕,更伴随着雌激素缺乏引发的骨质疏松、心血管疾病等远期并发症。传统激素替代疗法虽能缓解症状,却无法从根本上修复受损的卵巢功能。近年来,间充质干细胞(Mesenchymal Stem Cells, MSCs)疗法为POI治疗带来曙光,但其具体作用机制仍如雾里看花。
问题的关键在于卵巢微环境中两类关键细胞——颗粒细胞(Granulosa Cells, GCs)和卵泡膜间质细胞(Theca Interstitial Cells, TICs)的异常代谢。既往研究多聚焦于GCs,却忽视了TICs在激素合成和卵泡发育中的核心作用。更令人担忧的是,化疗药物环磷酰胺(Cyclophosphamide, CTX)会通过诱发TICs过度自噬导致卵巢功能衰竭,这种自噬过程受AMP活化蛋白激酶(AMP-activated protein kinase, AMPK)/雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)通路调控,但具体分子开关尚未破解。
滨州医学院的Yu Tang、Yu He等研究者将目光投向了人脐带间充质干细胞(human Umbilical Cord Mesenchymal Stem Cells, hUMSCs)分泌的外泌体(Exosomes, Exos)。这些直径70-200纳米的天然囊泡,堪称细胞间的"分子快递员",能携带miRNA等活性物质靶向病变组织。研究团队大胆假设:hUMSC-Exos可能通过特定miRNA调控TICs自噬,从而逆转POI进程。
为验证这一假说,研究者采用多学科交叉的研究策略。通过建立CTX诱导的POI大鼠模型,结合尾静脉注射Dil标记的hUMSC-Exos,证实外泌体具有卵巢趋向性。采用透射电镜、纳米颗粒追踪分析和Western blot完成外泌体鉴定,通过miRNA测序发现let-7a-5p是hUMSC-Exos中最丰富的miRNA。创新性地运用双荧光素酶报告基因验证let-7a-5p与AMPK的靶向关系,并通过let-7a-5p模拟物/抑制剂处理构建功能获得和缺失模型。所有实验均设立严格对照组,数据经SPSS 23.0统计分析。
研究结果层层递进揭示机制:

电镜显示典型茶托状外泌体结构,NTA检测直径70-200nm,Western blot证实CD63/CD9/HSP70阳性标记。活体成像显示外泌体富集于卵巢组织,免疫荧光证实其被TICs特异性摄取。
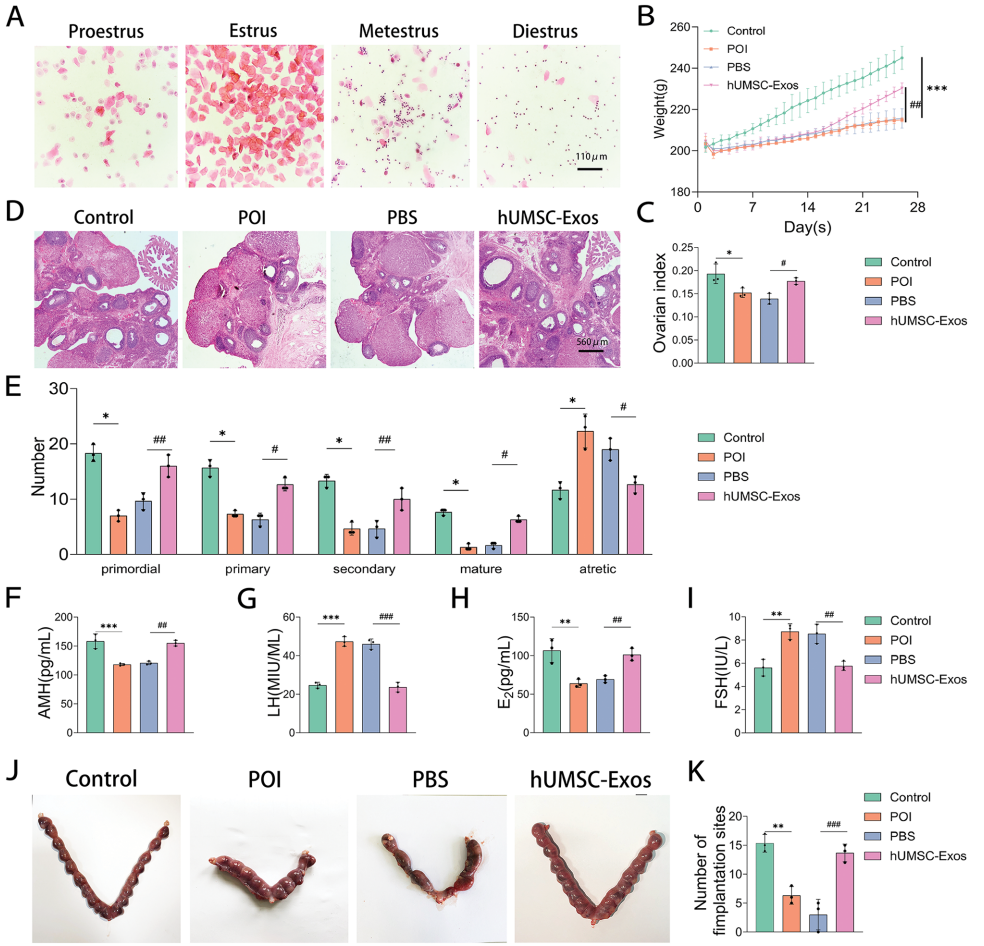
hUMSC-Exos治疗显著增加POI大鼠体重和卵巢湿重,H&E染色显示功能卵泡数量恢复,ELISA检测血清E2
和AMH水平回升,FSH/LH水平降低。生育实验证实胚胎着床数增加。

转录组分析发现POI卵巢中1056个差异基因,KEGG富集于自噬通路。Western blot显示hUMSC-Exos降低p-AMPK/AMPK比值,提高p-mTOR/mTOR比值,下调LC3II/LC3I和Beclin,上调p62。
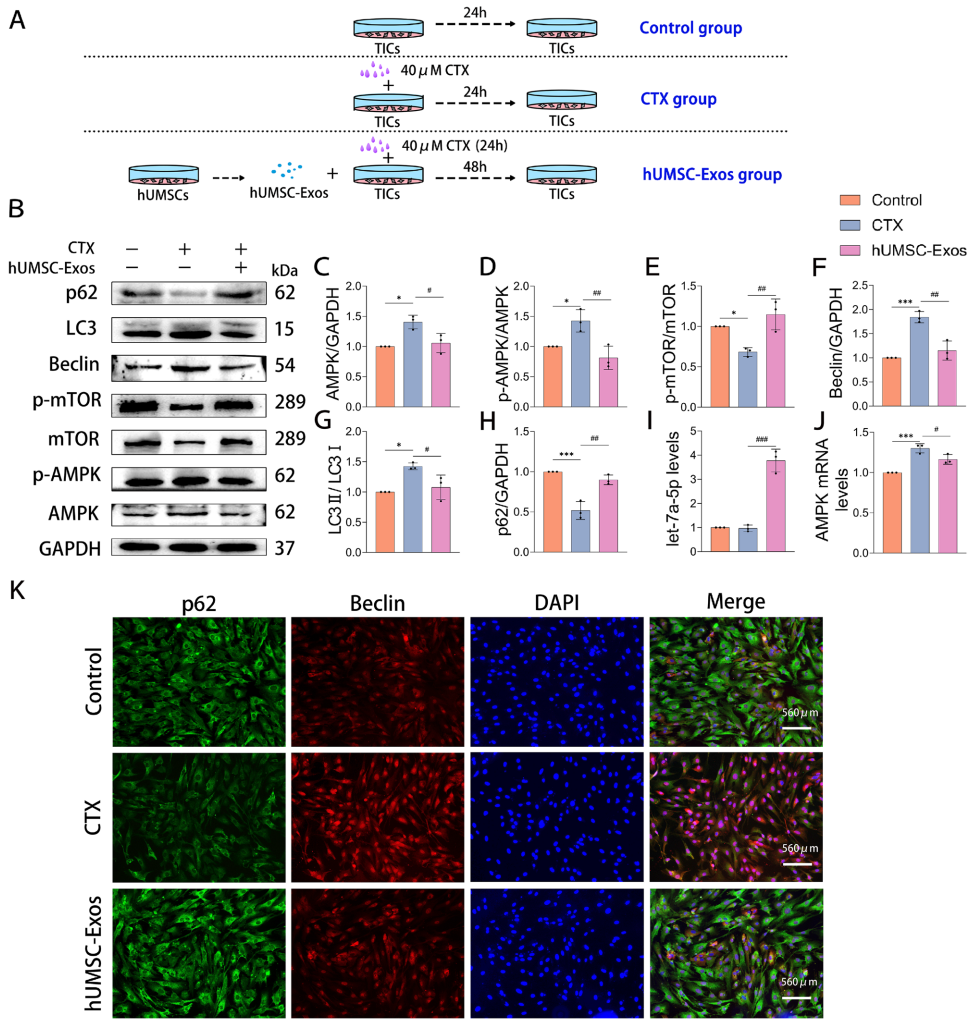
let-7a-5p占hUMSC-Exos miRNA总量的15.2%,双荧光素酶报告证实其直接靶向AMPK 3'-UTR。功能实验显示let-7a-5p抑制组自噬增强,而过表达组自噬被显著抑制。
这项发表于《Stem Cell Research & Therapy》的研究具有三重突破性意义:首先,首次阐明hUMSC-Exos通过let-7a-5p/AMPK/mTOR轴调控TICs自噬的分子机制,填补了POI治疗领域的知识空白;其次,开发了基于外泌体的无细胞治疗新策略,规避了干细胞移植的致瘤风险;最后,为临床转化提供双重靶点——既可系统注射hUMSC-Exos,也可局部递送let-7a-5p模拟物。正如研究者Hongchu Bao和Yanlian Xiong在讨论部分强调的,该发现不仅适用于化疗引起的POI,对特发性POI同样具有治疗潜力。
未来研究可沿三个方向深入:优化外泌体递送效率,开发let-7a-5p纳米载体;探索与其他miRNA的协同效应;开展大型动物实验推动临床转化。这项研究犹如点亮一盏明灯,为无数POI患者照亮了恢复生育力的希望之路。
 生物通微信公众号
生物通微信公众号
知名企业招聘