
-

生物通官微
陪你抓住生命科技
跳动的脉搏
钙离子依赖性孔道形成:揭示艰难梭菌二元毒素CDTb的跨膜机制及其在宿主细胞入侵中的关键作用
【字体: 大 中 小 】 时间:2025年06月10日 来源:Communications Biology 5.2
编辑推荐:
本研究揭示了艰难梭菌二元毒素(CDT)中CDTb组分的钙离子依赖性孔道形成机制。研究人员通过表面等离子体共振(SPR)、电化学阻抗谱(EIS)、冷冻电镜(cryoEM)和核磁共振(NMR)等技术,首次证明CDTb在钙离子浓度降低时能独立结合脂质双层并形成孔道,其机制涉及受体结合域1(RBD1)的构象动态变化。该发现为理解超毒力艰难梭菌感染的致病机制提供了新视角,并为靶向治疗开发奠定基础。
艰难梭菌感染(CDI)已被美国疾控中心列为五大最紧迫的细菌威胁之一,其中产生二元毒素(CDT)的超毒力菌株与更高的发病率和复发率相关。尽管已知CDT通过内体途径进入宿主细胞,但其分子机制尚未完全阐明。与炭疽毒素等依赖酸性pH触发膜插入的二元毒素不同,CDT的细胞结合组分CDTb展现出独特的钙离子(Ca2+
)依赖性激活机制——这一发现挑战了现有认知,为理解细菌毒素进化多样性提供了新线索。
来自美国马里兰大学医学院等机构的研究团队通过多学科技术手段,系统研究了CDTb的跨膜机制。研究发现当游离Ca2+
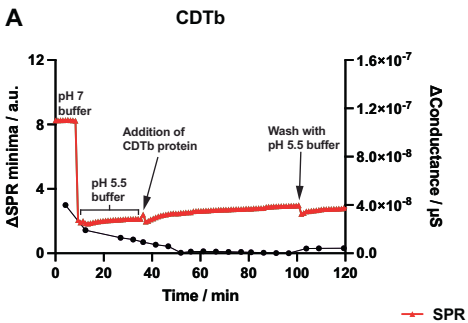
浓度从细胞外环境的2.3 mM降至内体中的<2 μM时,CDTb能独立于其酶组分CDTa,通过受体结合域1(RBD1)的构象重排触发脂质双层结合和孔道形成。这一成果发表于《Communications Biology》,为开发针对CDT相关感染的联合疗法提供了理论依据。
关键技术方法包括:1) 表面等离子体共振(SPR)与电化学阻抗谱(EIS)联用实时监测膜结合与孔道形成;2) 冷冻电镜解析Ca2+
缺失状态下CDTb的三维结构;3) 荧光光谱测定RBD1的Ca2+
结合亲和力;4) 定点突变(RBD1-D623A/D734A)验证功能位点;5) Vero细胞毒性实验评估突变体活性。
Ca2+
解离触发CDTb的膜结合与孔道形成
通过SPR/EIS同步检测发现,在含EGTA的缓冲液中(模拟内体低Ca2+
环境),CDTb能同时结合脂质双层并形成导电孔道,而单纯降低pH无此效应。这与其他二元毒素(如炭疽PA)的pH依赖机制形成鲜明对比。
冷冻电镜解析Ca2+
缺失状态结构
冷冻电镜揭示了两种Ca2+
缺失构象:I类结构中RBD2域扭曲(3.06 ?分辨率),II类保留完整RBD2(3.28 ?)。两者均显示RBD1域动态性增强,β-桶延伸部分形成,支持"预孔"状态假说。
RBD1突变体的结构功能验证
荧光滴定测定野生型RBD1的Ca2+
解离常数(CaKD
=40±10 μM),而双突变体D623A/D734A丧失结合能力(CaKD
10 mM)。圆二色谱证实突变体保留β-折叠二级结构,符合"熔球态"特征。冷冻电镜显示突变体(3.56 ?)与Ca2+
缺失野生型结构高度相似。
生理相关性验证
尽管热稳定性降低(Tm
降低3.3°C),CDTbD623A/D734A
仍能在pM浓度介导CDTa的细胞毒性(TC50
=560±60 pM),证实RBD1的Ca2+
感知功能对毒素递送至关重要。
研究结论指出,RBD1域作为Ca2+
传感器,其构象动态变化是CDTb膜插入的关键分子开关。当环境Ca2+
浓度低于40 μM时,RBD1从刚性结构转变为动态的"熔球态",解除其对β-桶域的空间阻遏,促使孔道形成。这一发现不仅完善了二元毒素的作用机制模型,更提示在治疗CDT相关感染时,需同时靶向大毒素(TcdA/TcdB)和CDT的Ca2+
依赖途径。
该研究的创新性体现在:1) 首次揭示Ca2+
浓度梯度(而非pH)是CDT激活的主要环境信号;2) 提出"构象动态驱动膜插入"的新范式;3) 为解释CDTb单独引发的炎症反应提供结构基础。这些发现对理解细菌毒素的进化适应策略具有普遍意义,并为针对其他AB型毒素的药物设计提供了新思路。

 生物通微信公众号
生物通微信公众号
知名企业招聘