
-

生物通官微
陪你抓住生命科技
跳动的脉搏
综述:淀粉样前体蛋白羧基末端片段作为阿尔茨海默病内溶酶体功能障碍的催化剂
【字体: 大 中 小 】 时间:2025年06月12日 来源:TRENDS IN Neurosciences 14.6
编辑推荐:
这篇综述聚焦于淀粉样前体蛋白C端片段(APP-CTFs)在阿尔茨海默病(AD)中的独立病理作用,揭示了其通过破坏内溶酶体稳态(如v-ATPase组装障碍、钙信号紊乱)和细胞器间通讯(如LE/Lys-ER膜接触位点失调)驱动神经退行性变的机制。作者提出靶向APP-CTFs或可成为AD预防性治疗的新策略,弥补当前β-淀粉样蛋白(Aβ)单靶点疗法的局限性。
传统AD研究长期聚焦于β-淀粉样蛋白(Aβ)的毒性,但最新证据表明其前体——淀粉样前体蛋白C端片段(APP-CTFs)才是早期内溶酶体功能障碍的独立驱动因子。APP通过α/β-分泌酶切割产生不同长度的CTFs(如C83/C99),而γ-分泌酶进一步加工这些片段。当PSEN1/2基因突变导致γ-分泌酶活性下降时,APP-βCTFs(C99)在晚期内体/溶酶体(LE/Lys)中异常累积,通过磷酸化Tyr682
位点与v-ATPase的V0亚基结合,破坏质子泵组装,引发溶酶体酸化障碍。
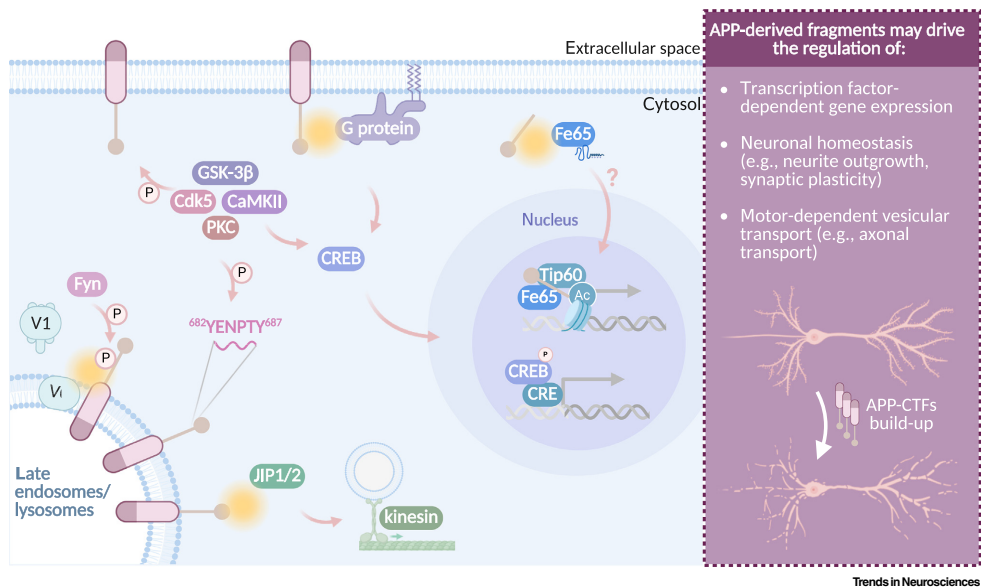
在LE/Lys-内质网(ER)膜接触位点(MCSs),堆积的APP-CTFs扭曲细胞器形态,阻碍胆固醇转运和钙离子交换。与此同时,未被充分修剪的Aβ42在酸性环境中聚合,形成"双重打击"模型——APP-CTFs从膜结构破坏功能,Aβ42从腔内物理损伤细胞器。这种协同效应在家族性AD(FAD)和唐氏综合征模型中尤为显著,表现为Rab5阳性内体膨大、自噬流阻滞等特征性病变。
γ-分泌酶对APP-CTFs的降解不仅是清除代谢废物,更是终止其异常信号的关键。研究发现,APP-CTFs能激活G蛋白-CREB通路促进树突生长,但持续存在会导致信号失衡。针对这一机制,调节剂(如低剂量BACE1抑制剂)或基因编辑(如引入冰岛突变A673T)可能通过精准调控APP切割比例,实现病理片段清除与生理功能保留的平衡。

尽管APP-CTFs的病理作用逐渐明晰,其如何精确调控tau磷酸化、影响神经炎症仍有待探索。超分辨显微技术将助力解析APP-CTFs在亚细胞结构的动态分布,而类Blarcamesine等改善自噬的药物可能成为联合治疗的新选择。这场关于"切割平衡"的探索,正在改写AD治疗的规则手册。
 生物通微信公众号
生物通微信公众号
知名企业招聘