
-

生物通官微
陪你抓住生命科技
跳动的脉搏
基于多组学分析的铜死亡相关基因预后模型在胃腺癌中的临床价值研究
【字体: 大 中 小 】 时间:2025年06月13日 来源:Clinical Epigenetics 4.8
编辑推荐:
本研究针对胃腺癌(STAD)高发病率与预后差的临床难题,创新性地通过多组学(TCGA/GEO)数据解析铜死亡(cuproptosis)相关基因的突变、拷贝数变异、甲基化及可变剪接等特征,构建了首个整合PDHB拷贝数、CDKN2A甲基化等关键指标的多组学预后模型。研究发现MTF1过表达可抑制癌细胞凋亡并促进侵袭,为STAD的免疫治疗策略提供了新靶点,发表于《Clinical Epigenetics》具有重要转化价值。
研究背景与意义
胃腺癌(STAD)是全球第六大高发恶性肿瘤,中国新发病例占比高达43.5%,术后5年复发率可达70%。当前临床面临早期诊断困难、治疗响应率低等挑战,亟需开发新型预后标志物。铜死亡(cuproptosis)作为铜离子诱导的新型细胞死亡方式,通过靶向三羧酸循环(TCA)中脂酰化蛋白触发线粒体应激,但其在STAD中的作用机制尚不明确。
研究设计与方法
研究人员整合TCGA和GSE13911/GSE62254队列的基因组、表观组和转录组数据,系统分析FDX1、CDKN2A等10个铜死亡核心基因的多组学特征。采用MOVICS算法构建预后模型,并通过MTF1过表达实验验证功能机制。关键技术包括:1) 多组学数据整合分析;2) 共识聚类算法;3) 细胞Transwell和流式凋亡检测。
研究结果
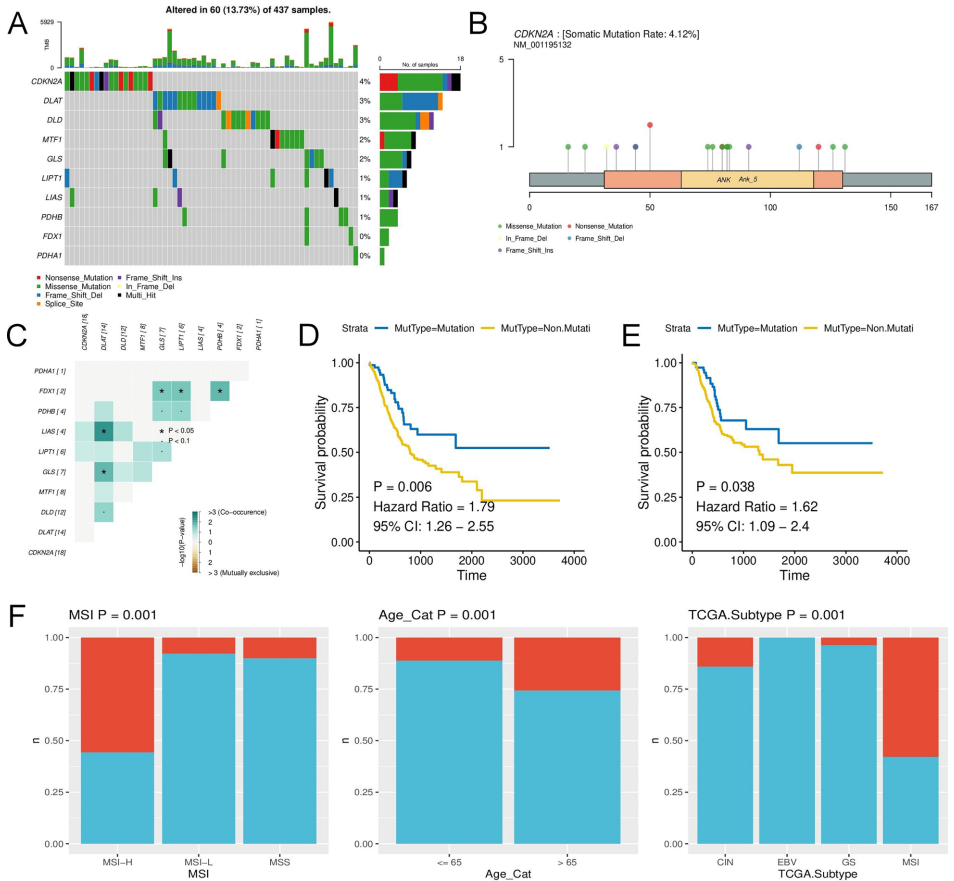
1. 基因组变异特征
CDKN2A是突变频率最高的基因(18例),其结构域突变与不良预后显著相关。PDHB拷贝数增加提示更好生存率(p<0.05),且与微卫星不稳定性(MSI)呈正相关。
2. 表观遗传调控
CDKN2A启动子区超甲基化与不良预后相关,其中cg15826972位点甲基化使mRNA表达降低2.3倍。LIAS基因的5个CpG岛构成LA复合体,其甲基化水平与肿瘤分期显著相关。
3. 转录组特征
可变剪接分析揭示CDKN2A外显子跳跃(ES)事件可延长患者生存期(HR=0.62),而GLS基因的APA长异构体预示更差预后。MTF1高表达组显示Th17细胞浸润增加和PD-L1上调。

4. 功能实验验证
MTF1过表达使MKN-45细胞凋亡率降低37%(p<0.01),侵袭能力提升2.1倍,证实其在STAD进展中的双重调控作用。
结论与展望
该研究首次建立铜死亡相关多组学预后模型,将STAD患者分为CS1/CS2亚型,其中CS1组总生存期缩短但免疫检查点(CD86/CD80)表达升高,提示对免疫治疗潜在响应。发现MTF1通过调控糖酵解和脂肪酸代谢通路影响肿瘤微环境,为STAD的铜靶向治疗提供理论依据。未来需进一步探索铜螯合剂与PD-1抑制剂的联合治疗策略。
 生物通微信公众号
生物通微信公众号
知名企业招聘