
-

生物通官微
陪你抓住生命科技
跳动的脉搏
综述:揭秘cGAS-STING通路:在肿瘤免疫微环境中的精准调控
【字体: 大 中 小 】 时间:2025年06月13日 来源:Molecular Cancer 27.7
编辑推荐:
这篇综述深入探讨了cGAS(环GMP-AMP合成酶)-STING(干扰素基因刺激因子)通路在肿瘤免疫微环境(TIME)中的双重调控作用。文章系统阐述了该通路通过识别胞质DNA(如放疗/化疗导致的核DNA泄漏)激活先天免疫,产生I型干扰素(IFN-I)重塑TIME的机制,同时揭示了其在晚期肿瘤中促进免疫逃逸的"双刃剑"特性。作者重点分析了该通路在树突状细胞(DCs)、T细胞、肿瘤相关巨噬细胞(TAMs)等免疫细胞中的差异化调控,并综述了靶向该通路的激动剂开发(如CDNs衍生物、DMXAA)与联合治疗策略(如PD-1抑制剂、CAR-T疗法)的临床转化前景。
作为细胞质DNA的免疫哨兵,cGAS-STING通路通过识别异常定位的双链DNA(dsDNA),在先天免疫应答和肿瘤免疫监视中发挥核心作用。当基因组不稳定或线粒体应激导致DNA泄漏至胞质时,cGAS被激活并催化合成第二信使cGAMP,进而触发STING依赖的信号级联反应。这一过程最终诱导IFN-I和促炎因子的产生,重塑肿瘤免疫微环境(TIME)的生态特征。

在TIME这个由肿瘤细胞、内皮细胞和多种免疫细胞组成的复杂生态系统中,cGAS-STING通路通过调控不同免疫细胞亚群的功能状态,演绎着抗肿瘤免疫的"交响乐"。
树突状细胞(DCs)的抗原呈递革命
传统1型树突细胞(cDC1)是启动CD8+
T细胞活化的关键角色。研究表明,纳米颗粒STING激动剂PolySTING能特异性激活cDC1中的STING-IFN-I信号轴,显著增强其交叉呈递能力。而STING激动剂ADU-S100与TIM-3阻断剂的联用,则通过上调MHC-II和共刺激分子CD80/CD86的表达,促进cDC2的成熟和CD4+
T细胞活化。
T细胞亚群的精准调控艺术
在CD8+
T细胞中,cGAS-STING激活通过诱导TCF1表达维持干细胞样特性,同时通过抑制Akt通路驱动细胞毒性效应。CD4+
T细胞则通过STING-IFN-β轴与cDC1建立双向对话,形成从先天免疫到适应性免疫的级联放大效应。值得注意的是,γδ T细胞的功能状态受到cGAS-STING通路的精确调控——早期肿瘤中cGAMP通过磷酸化Eomes促进IFN-γ产生,而晚期肿瘤中TGF-β则通过表观遗传机制抑制STING表达。
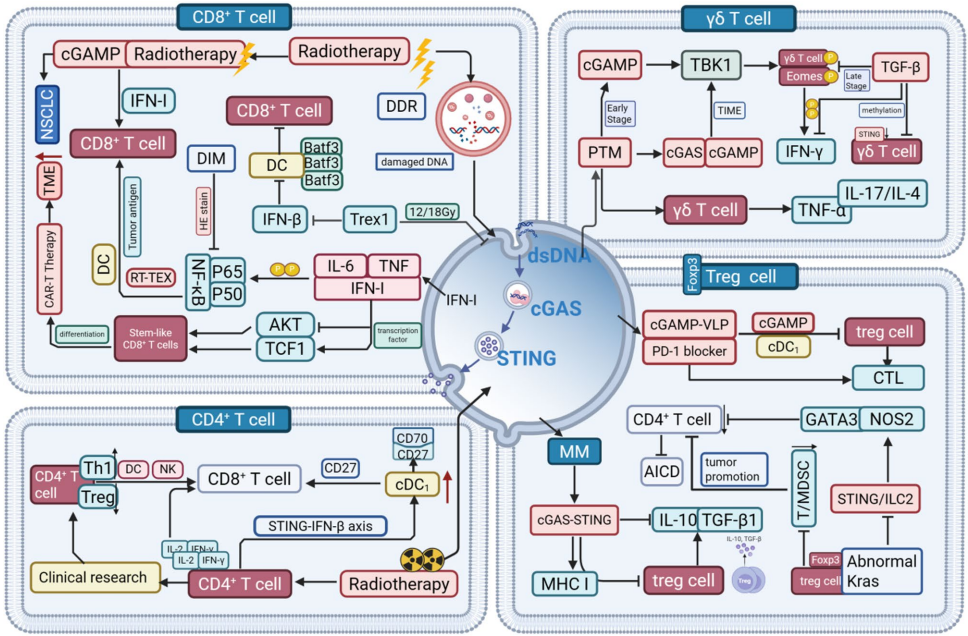
巨噬细胞的极化平衡术
肿瘤相关巨噬细胞(TAMs)的M1/M2极化状态直接影响抗肿瘤免疫效果。在肝癌中,cGAS-STING激活通过STING-IRF3-STAT1轴驱动M1极化,但同时也会诱导PD-L1表达形成免疫抑制。而在非小细胞肺癌模型中,STING激动剂DMXAA能将骨髓来源的M2巨噬细胞重编程为M1表型,实现肿瘤血管特异性破坏。
激动剂开发的三大方向
联合治疗的协同效应
尽管cGAS-STING通路在抗肿瘤免疫中潜力巨大,但在染色体不稳定(CIN)肿瘤中,该通路的持续激活反而会促进转移。研究发现CIN驱动的慢性STING激活通过非经典NF-κB通路抑制抗肿瘤免疫,这为STING棕榈酰化抑制剂的应用提供了理论依据。此外,全身性STING激活可能引发细胞因子风暴样反应,而T细胞中高表达的STING使其更易发生激动剂诱导的凋亡,这些挑战推动着组织靶向型调节剂的研发。
理解cGAS-STING通路在时空动态平衡中的调控机制,是突破当前免疫治疗瓶颈的关键。整合系统生物学和合成免疫学方法,开发pH响应型纳米颗粒或工程化间充质干细胞(MSCs)等递送系统,将为实现该通路的精准调控开辟新途径。多组学指导的组合策略(如STING激动剂联合表观药物或代谢调节剂)有望克服肿瘤微环境的异质性,开启癌症免疫治疗的新篇章。
 生物通微信公众号
生物通微信公众号
知名企业招聘