
-

生物通官微
陪你抓住生命科技
跳动的脉搏
综述:脑室下区神经干细胞:帕金森病脑修复的潜在干细胞库
【字体: 大 中 小 】 时间:2025年06月13日 来源:Stem Cell Reports 5.9
编辑推荐:
这篇综述探讨了脑室下区(SVZ)神经干细胞(NSCs)在帕金森病(PD)治疗中的潜力。作者系统分析了PD病理对NSCs行为的影响,包括多巴胺耗竭、α-突触核蛋白(aSyn)积累及LRRK2等基因突变的作用机制,并综述了通过Wnt/β-catenin通路激活、生长因子(如BDNF、GDNF)和神经节苷脂(GM1/GD3)等策略促进神经发生的最新进展。研究强调内源性NSCs在衰老和病变大脑中仍保持可塑性,为PD修复治疗提供了新思路。
神经干细胞:帕金森病修复的新希望
帕金森病(PD)作为第二大神经退行性疾病,其特征是黑质致密部A9多巴胺能神经元的进行性丧失。尽管现有治疗如左旋多巴能缓解症状,但无法阻止疾病进展。近年来,利用内源性神经干细胞(NSCs)进行脑修复的策略备受关注。
神经干细胞的生物学特性
成年哺乳动物大脑中存在两个神经源性区域:海马齿状回的颗粒下区和侧脑室旁的脑室下区(SVZ)。SVZ包含处于静息状态的NSCs、神经祖细胞(NPCs)、少突胶质祖细胞(OPCs)等多种细胞类型。静息态NSCs具有低代谢活性和高VCAM1表达特征,而激活态NSCs则表现出EGFR和Nestin高表达。研究发现,衰老过程中BMP-4/Notch信号增强会促进NSCs静息,而Wnt/β-catenin通路激活可逆转这种状态。
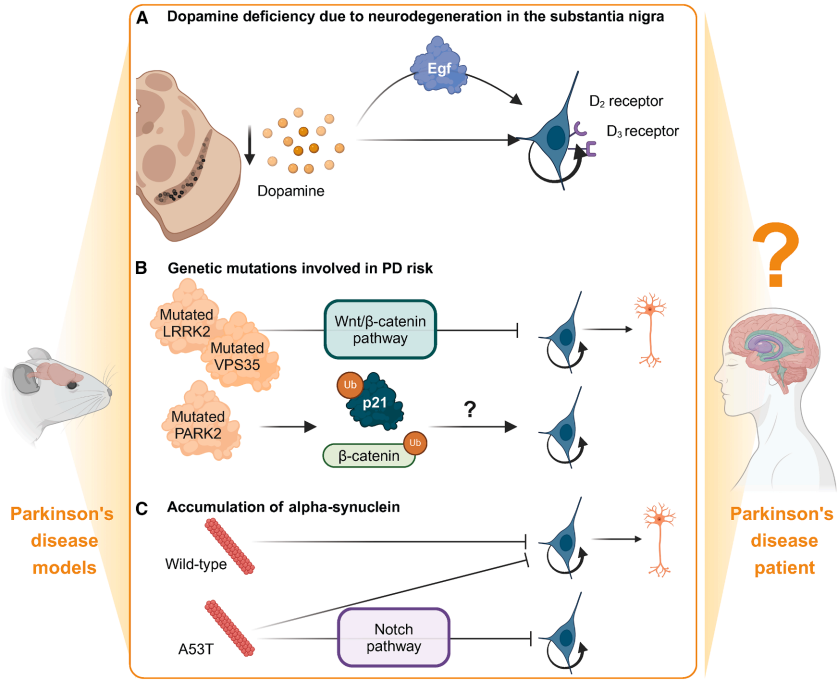
PD病理对神经干细胞的影响
多巴胺耗竭是PD的核心特征。SVZ接受中脑多巴胺能神经元的投射,NSCs表达D2/D3受体。在6-OHDA和MPTP等PD模型中,多巴胺耗竭对NSCs增殖的影响存在争议,可能与损伤程度和评估时间点有关。值得注意的是,PD患者尸检显示SVZ的NSCs数量与对照组无显著差异。
基因突变方面,LRRK2 G2019S突变通过抑制Wnt/β-catenin信号和Let-7a miRNA活性,损害NSCs增殖和分化。VPS35 D620N突变则通过影响retromer复合体功能扰乱Wnt信号传导。α-突触核蛋白的异常积累(特别是A53T突变体)会通过p53介导的Notch1抑制减少神经发生。
促进神经发生的治疗策略
多巴胺激动剂如普拉克索可通过D2/D3受体激活促进NSCs增殖。Wnt通路激动剂如GSK-3β抑制剂AR-AO14418能增加黑质多巴胺能神经元数量。生长因子治疗中,脑源性神经营养因子(BDNF)和胶质细胞源性神经营养因子(GDNF)显示出促进NSCs分化为多巴胺能神经元的潜力。
神经节苷脂GM1和GD3展现出独特作用:GD3通过抑制p21维持NSCs静息池,而GM1则通过核受体相关1(Nurr1)促进多巴胺能神经元分化。鼻内给药GM1可增加嗅球中酪氨酸羟化酶(TH)阳性神经元数量。
挑战与展望
尽管前景广阔,内源性NSCs治疗仍面临多重挑战:新生的多巴胺能神经元需要迁移至损伤部位并实现功能整合;PD病理环境可能影响新生神经元存活;需开发时空精确的激活策略以避免肿瘤风险。单细胞测序等新技术正在揭示人SVZ NSCs的分子特征,为精准调控提供新靶点。
未来研究应着重解决:如何定向诱导NSCs分化为特定亚型多巴胺能神经元;如何克服衰老和疾病微环境对神经发生的抑制;如何将神经再生与抗病理策略(如α-突触核蛋白清除)相结合。这些突破将为PD治疗开辟全新途径。
 生物通微信公众号
生物通微信公众号
知名企业招聘