
-

生物通官微
陪你抓住生命科技
跳动的脉搏
TDP-43相分离调控新机制:斑马鱼和小鼠模型中赖氨酸136位点对神经退行性病变的关键作用
【字体: 大 中 小 】 时间:2025年06月14日 来源:iScience 4.6
编辑推荐:
本研究揭示了TDP-43蛋白相分离(LLPS)在神经退行性疾病中的调控机制。澳大利亚麦考瑞大学团队通过斑马鱼和小鼠模型,发现K136位点修饰可独立于翻译后修饰(PTM)调控TDP-43的核质定位、RNA结合能力和相分离特性,为肌萎缩侧索硬化症(ALS)等TDP-43蛋白病的治疗提供了新靶点。该成果发表于《iScience》。
神经退行性疾病领域长期存在一个关键谜题:为何TDP-43蛋白会从正常的核内定位错误地聚集在细胞质中形成病理性包涵体?这种异常聚集是肌萎缩侧索硬化症(ALS)、额颞叶痴呆(FTD)等疾病的标志性特征,甚至与阿尔茨海默病(AD)等老年相关脑病密切相关。尽管科学家已发现TDP-43可通过液-液相分离(LLPS)形成生物分子凝聚体(BMC),但调控这一过程的分子机制仍不清楚,特别是翻译后修饰(PTM)如何影响TDP-43的相分离行为。
麦考瑞大学医学院的研究团队在《iScience》发表的研究中,聚焦于TDP-43蛋白第136位赖氨酸(K136)的关键作用。这个位于RNA识别基序1(RRM1)结构域的氨基酸残基,既可能被SUMO化修饰,也可能被乙酰化修饰。通过构建系列突变体,研究人员在两种脊椎动物模型中系统研究了K136对TDP-43相分离、核质分布和聚集特性的调控作用。
研究采用了多项关键技术:在斑马鱼脊髓运动神经元中表达eGFP标记的TDP-43突变体,通过荧光漂白恢复(FRAP)分析相分离动力学;利用UV交联免疫沉淀(CLIP)技术评估RNA结合能力;开发神经元特异性腺相关病毒(AAV)CAP-B10载体系统在小鼠中枢神经系统表达人类TDP-43变体。
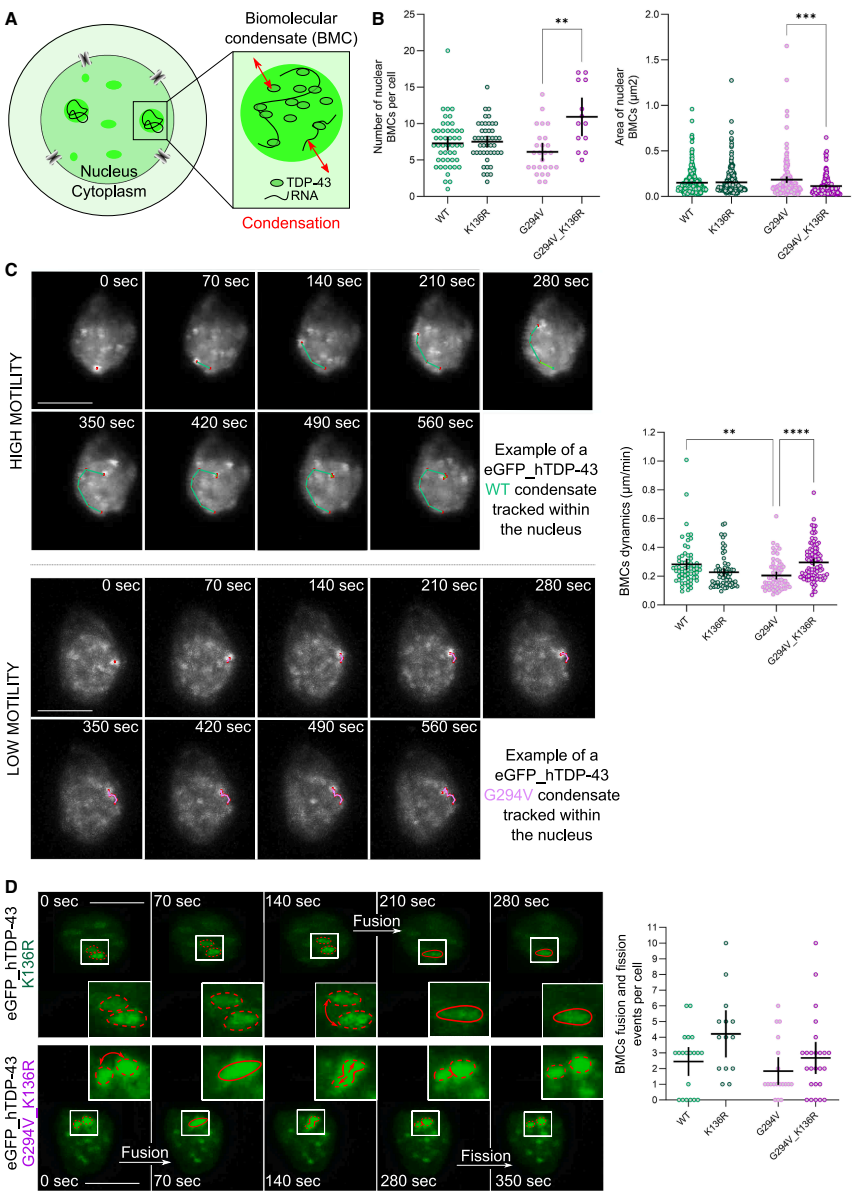
研究结果部分,"Lysine 136 influences TDP-43 subcellular compartmentalization in vivo"显示,将K136突变为精氨酸(R)显著增加了TDP-43的核内保留,减少了细胞质聚集。在斑马鱼模型中,TDP-43K136R
的胞质/核荧光强度比(Fmin
/Fmax
)显著低于野生型(WT)。

"Cytoplasmic TDP-43 foci are affected by amino acid substitutions"部分发现,K136R突变使含有细胞质聚集体的运动神经元比例从WT的18.3%降至4.2%,且每个神经元内的聚集体数量也显著减少。
"Lysine 136 affects the characteristics and dynamics of nuclear TDP-43 condensates in vivo"揭示了K136突变改变了核内BMC的动力学特性。与WT相比,TDP-43K136R
的BMC移动速度更快,融合和分裂事件更频繁。
"Lysine 136 influences the molecular dynamics of TDP-43"通过FRAP分析发现,K136R突变使荧光恢复半衰期从WT的65.7秒大幅缩短至14.3秒,表明分子交换速率显著加快。这种效应在模拟乙酰化的K136Q和非带电的K136A突变体中也得到重现,说明K136的调控作用不依赖于特定PTM类型。
"Lysine 136 impacts biomolecular condensate characteristics in mice"部分验证了斑马鱼结果在哺乳动物模型的普适性。AAV介导的TDP-43K136R
在小鼠神经元中形成更多核内BMC(19.9个/细胞 vs WT的3.1个),同时核内弥散TDP-43减少。
研究结论强调,K136是调控TDP-43相分离和聚集的关键分子"开关"。这种调控作用独立于该位点的具体修饰类型,主要通过影响RNA结合能力实现。在ALS相关突变体TDP-43G294V
背景下,K136R突变能部分挽救病理表型,证实了该位点的治疗潜力。研究建立的斑马鱼和小鼠模型为TDP-43蛋白病研究提供了重要平台,AAV-CAP-B10载体系统为神经退行性疾病的基因治疗开辟了新途径。
这项研究的突破性在于:首次在活体脊椎动物中证实单个氨基酸残基可独立于PTM类型调控TDP-43相分离;阐明了K136通过影响RNA结合来调节TDP-43功能的分子机制;为开发针对TDP-43相分离过程的小分子调节剂提供了精确靶点。这些发现对理解神经退行性疾病的发病机制和开发新型治疗策略具有重要意义。
 生物通微信公众号
生物通微信公众号
知名企业招聘