
-

生物通官微
陪你抓住生命科技
跳动的脉搏
基于适体标记巨噬细胞膜包被的双响应锰基金属有机框架:增强化学动力学治疗与磁共振成像的创新策略
【字体: 大 中 小 】 时间:2025年06月17日 来源:Cancer Nanotechnology 4.5
编辑推荐:
本研究针对癌症治疗中化学动力学疗法(CDT)金属离子不足和肿瘤微环境(TME)高谷胱甘肽(GSH)的挑战,开发了pH/GSH双响应的锰基金属有机框架(Mn MOFs)纳米平台Apt-Mn MOF-DOX-MCM。通过负载阿霉素(DOX)并包覆巨噬细胞膜(MCM)及PTK7靶向适体Sgc8-c,实现了84.95%的药物负载率,在酸性/高GSH条件下释放Mn2+ 触发类芬顿反应,同时作为MRI造影剂。体外实验显示其对B16F0黑色素瘤细胞具有显著杀伤作用,动物实验证实其显著抑制肿瘤生长并延长生存期,为癌症诊疗一体化提供了新思路。
癌症治疗领域长期面临两大难题:传统化学动力学疗法(CDT)依赖的金属离子在肿瘤部位浓度不足,而肿瘤微环境(TME)中过量的抗氧化剂谷胱甘肽(GSH)又会中和治疗产生的活性氧(ROS)。更棘手的是,现有诊疗系统往往难以兼顾精准递送和实时监测。针对这一"双重困境",马什哈德医科大学的研究团队在《Cancer Nanotechnology》发表了一项突破性研究,他们将锰基金属有机框架(Mn MOFs)的氧化能力、磁共振成像(MRI)特性与生物膜伪装技术巧妙结合,构建了一种"智能纳米导弹"——Apt-Mn MOF-DOX-MCM。
这项研究的关键技术路线包括:1) 以4,4'-二硫代二苯甲酸(DTBA)为配体合成pH/GSH双响应Mn MOFs;2) 通过膜融合技术将RAW264.7巨噬细胞膜(MCM)包裹载药纳米颗粒;3) 采用EDC/NHS化学偶联PTK7靶向适体Sgc8-c;4) 通过B16F0黑色素瘤模型和C57BL/6小鼠开展体内外疗效评估;5) 利用1.5T MRI系统进行造影效果分析。
材料表征验证纳米结构
通过FT-IR证实Mn-O键形成(574 cm-1
),PXRD显示特征晶体结构,VSM检测到0.68 emu/g饱和磁化强度。TEM显示粒径133.69±17.07 nm的球形结构,MCM包覆后增至197.63±20.66 nm,适体修饰使Zeta电位降至-13.71 mV。

智能药物释放与ROS调控
在pH 5.4/10 mM GSH条件下,72小时内DOX释放率达90%,远超生理环境(pH 7.4)的5%。甲基蓝(MB)降解实验证实Mn2+
能催化HCO3
-
/CO2
体系中产生羟基自由基('OH),10 mM GSH存在时Mn MOFs的MB降解效率(27%)是MnCl2
的2.7倍。

靶向治疗优势显著
流式细胞术显示Apt-Mn MOF-DOX-MCM在PTK7+
的B16F0细胞摄取量是对照组CHO细胞的3.2倍。克隆形成实验表明其抑制率达92%,IC50
(0.05 μg/mL)优于游离DOX(0.08 μg/mL)。

体内疗效与诊疗协同
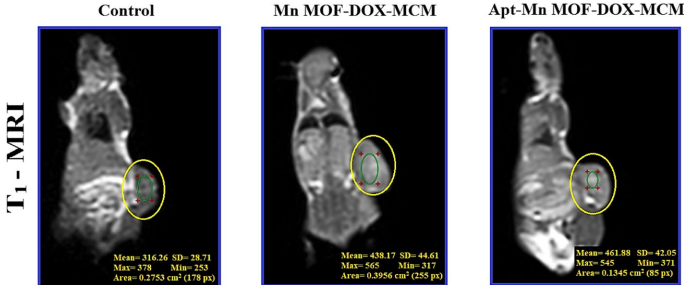
单次静脉注射(5 mg/kg DOX当量)使小鼠肿瘤体积缩小78%,19天存活率100%。MRI显示肿瘤部位T1
加权信号增强,离体荧光证实靶向组肿瘤药物蓄积量是非靶向组的2.3倍。
这项研究开创性地将三种前沿技术——金属有机框架化学、细胞膜伪装和适体靶向——融为一体。Mn MOFs不仅作为药物载体和ROS发生器,其Mn2+
节点更实现了治疗过程的可视化监控。特别值得注意的是,MCM包覆不仅延长了血液循环时间,还赋予纳米颗粒天然的肿瘤趋向性,而Sgc8-c适体则像"精确制导系统"般将药物定向输送至PTK7高表达的癌细胞。这种"三位一体"的设计思路为克服肿瘤多重耐药、实现诊疗一体化提供了普适性方案,未来或可拓展至其他金属离子(如Cu2+
、Co2+
)基纳米平台的开发。
 生物通微信公众号
生物通微信公众号
知名企业招聘