
-

生物通官微
陪你抓住生命科技
跳动的脉搏
基于全外显子组测序的肥胖单基因遗传诊断:揭示12.9%的肥胖患者存在致病或潜在致病变异
【字体: 大 中 小 】 时间:2025年06月17日 来源:International Journal of Obesity 4.2
编辑推荐:
为解决肥胖遗传诊断率不确定及现有基因panel覆盖不全的问题,德国莱比锡大学团队通过分析521例肥胖患者的全外显子组测序数据,发现5.8%患者确诊单基因肥胖,7.1%携带潜在致病变异。研究证实儿童和综合征型肥胖诊断率更高,且40%致病基因未被现有panel覆盖,为肥胖精准诊疗提供了重要依据。
肥胖已成为全球公共卫生危机,过去30年成人肥胖率翻倍、儿童肥胖率翻两番。尽管BMI遗传度高达40-80%,但单基因肥胖的诊断仍面临挑战:现有研究多局限于特定基因panel,而全外显子组测序(WES)在临床诊断中的应用价值尚不明确。更棘手的是,肥胖常被当作其他遗传疾病的"次要症状"而漏报,导致大量潜在致病基因被忽视。
德国莱比锡大学医学院人类遗传学研究所的Robert Künzel团队在《International Journal of Obesity》发表研究,通过对521例肥胖患者(84.7%接受WES检测)的系统分析,揭示了单基因肥胖的分子流行病学特征。研究发现12.9%的患者携带明确或潜在致病变异,其中MC4R基因变异占比最高(26.7%),而40%的致病基因未被现有肥胖panel收录。这一成果为拓展遗传检测指征、优化基因panel设计提供了关键证据。
研究采用TWIST Human Core Exome等五种外显子捕获试剂盒进行WES,结合TruSight One panel检测(15.3%病例),通过Varvis/Varfeed软件按ACMG标准进行变异解读。521例患者中396例为儿童,299例伴发育迟缓/智力障碍/畸形(DD/ID/D),建立迄今最大规模的肥胖遗传诊断真实世界队列。
患者特征
队列中儿童占76%(396/521),57.4%伴DD/ID/D。通过德国Kromeyer-Hauschild标准划分肥胖程度,发现51.1%属严重肥胖(成人BMI≥40 kg/m2
,儿童≥99.5百分位)。
诊断率分析
5.8%(30/521)确诊单基因肥胖,MC4R变异占1.5%总队列(8例),16p11.2微缺失(5例)和PHIP/SRRM2变异(各3例)紧随其后。值得注意的是,7%伴DD/ID/D的患者确诊遗传性肥胖,显著高于非综合征组(4.1%)。

预测因素
儿童诊断率(6.3%)高于成人(4%),但严重肥胖组诊断率(5.6%)反低于轻度肥胖组(9%)。

panel对比
公共肥胖panel仅覆盖60%确诊基因,对综合征型肥胖基因遗漏率达50%。
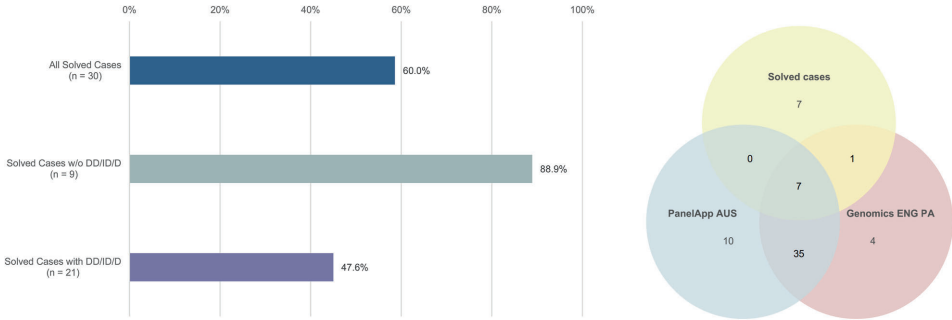
研究突破性地揭示:现有临床标准可能低估遗传性肥胖风险——严重肥胖并非最佳预测指标,而伴DD/ID/D的儿童更需遗传检测。发现SRRM2等新型致病基因提示WES的不可替代性,尤其对非典型病例。作者强调应规范肥胖表型记录,并建议将遗传检测前移至减重手术前评估。
这项研究为全球10亿肥胖人群的精准分型提供路线图:通过WES可识别数百万潜在受益于靶向治疗(如MC4R激动剂setmelanotide)的患者。随着《EMANATE》临床试验推进,这些发现将加速从基因诊断到精准干预的转化进程,改写肥胖诊疗范式。
 生物通微信公众号
生物通微信公众号
知名企业招聘