
-

生物通官微
陪你抓住生命科技
跳动的脉搏
乳腺腋窝脂肪组织来源淋巴管内皮细胞转录组特征揭示乳腺癌淋巴转移新机制
【字体: 大 中 小 】 时间:2025年06月18日 来源:Breast Cancer Research 6.1
编辑推荐:
本研究针对乳腺癌淋巴转移机制不清的问题,通过创新性建立从患者腋窝脂肪组织分离淋巴管内皮细胞(LECs)的方法,首次发现具有淋巴转移的乳腺癌患者LECs存在独特的TGF-β和VEGF信号通路激活特征。该研究为理解肿瘤微环境中LECs的异质性提供了新视角,为开发预测淋巴转移的生物标志物奠定基础。
乳腺癌是全球女性最常见的恶性肿瘤,其致命性主要源于转移扩散。在众多转移途径中,淋巴系统扮演着关键角色——约75%的乳腺癌患者首次转移发生在腋窝淋巴结。然而,长期以来科学家们对淋巴管内皮细胞(LECs)在癌症转移中的具体作用机制知之甚少,主要原因在于缺乏可靠的患者源性LECs获取方法。现有研究多依赖商业化的皮肤来源LECs或动物模型,这些系统难以真实反映乳腺癌特异性的微环境特征。
日本癌症研究会癌症研究所的Asumi lesato团队在《Breast Cancer Research》发表的重要研究,开创性地建立了从手术废弃的腋窝脂肪组织中分离患者源性LECs(PD-LECs)的技术体系。这项研究不仅解决了实验材料来源的瓶颈问题,更首次揭示了具有淋巴转移的乳腺癌患者其LECs存在独特的分子特征,为理解肿瘤-淋巴管互作提供了全新视角。
研究人员采用多技术联用的策略开展研究:首先利用磁珠分选去除CD45+
白细胞,再通过荧光激活细胞分选(FACS)获取CD31+
/PDPN+
双阳性LECs;通过VEGF-C刺激实验和管腔形成实验验证细胞功能;采用RNA测序分析来自20例患者的LECs转录组特征;使用基因集富集分析(GSEA)鉴定差异通路。所有样本均来自癌症研究所医院接受乳腺癌手术患者的腋窝脂肪组织。
【LEC的分离与鉴定】
研究团队创新性地选择手术中常规废弃的腋窝脂肪组织作为细胞来源,通过优化组织消化和分选流程,成功从17例患者样本中分离出功能性LECs。这些被命名为AA-LEC(腋窝脂肪组织来源LEC)的细胞在VEGF-C刺激下表现出显著增殖增强(IC325细胞第5天增殖1.81倍,p<0.05),并在基底膜提取物(BME)上形成典型管腔结构,证实其具备LECs的关键生物学特性。
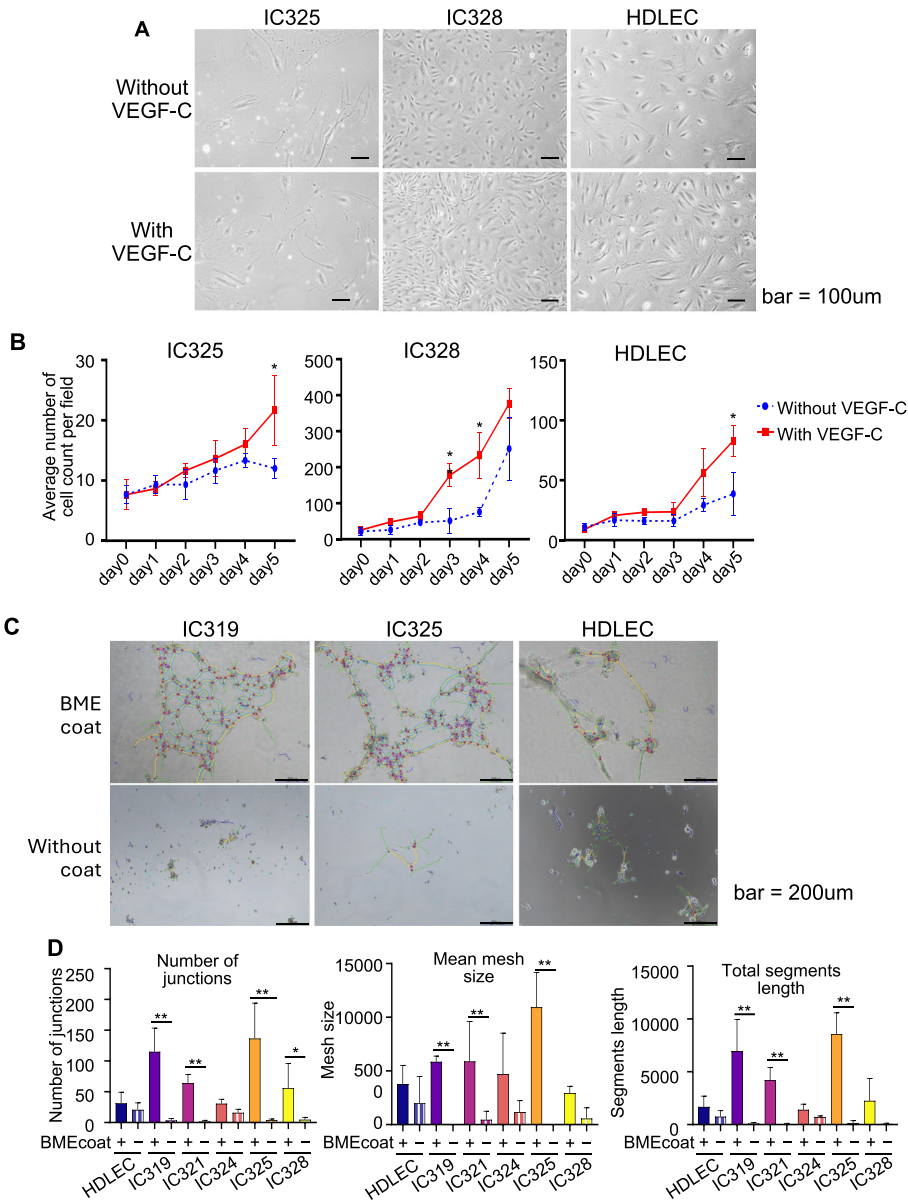
【基因表达特征分析】
转录组分析揭示AA-LECs与商业化HDLECs存在显著差异。通过比较来自淋巴转移阳性(AA-LEC325/328/351/353)和阴性(AA-LEC321/343/347/349)患者的LECs,发现121个差异表达基因(50个上调,71个下调)。特别值得注意的是,淋巴转移阳性组的LECs高表达多种细胞外基质重塑相关基因,暗示其可能更有利于肿瘤细胞侵袭。
【信号通路激活特征】
GSEA分析显示,淋巴转移阳性组的LECs显著富集于TGF-β和VEGF信号通路。其中TGF-β通路相关基因如SMAD6、TGFBR2等表达上调(NES=1.65,p=0.032),VEGF通路中FLT1、NRP1等基因也呈现激活状态(NES=1.72,p=0.028)。这些发现为理解淋巴转移的分子机制提供了重要线索,提示这些通路可能作为潜在治疗靶点。

这项研究具有多重重要意义:在方法学层面,建立了首个从临床样本获取功能性LECs的标准化流程,解决了该领域长期依赖商业细胞系的问题;在机制研究层面,首次揭示乳腺癌患者LECs存在疾病状态相关的异质性,特别是发现淋巴转移阳性患者LECs中TGF-β和VEGF通路的特异性激活;在临床转化层面,鉴定的差异表达基因谱为开发淋巴转移预测标志物提供了候选分子库。
研究也存在若干局限性:PD-LECs体外培养周期较短(通常仅维持2-4代),限制了长期实验的开展;样本量相对较小(8例成功培养),需要在更大队列中验证发现的分子特征。未来研究可探索LECs永生化方法延长培养时间,并通过多中心合作扩大样本规模。此外,深入解析TGF-β通路如何调控LECs促转移功能,将有助于开发针对淋巴转移的精准干预策略。
这项研究开辟了乳腺癌淋巴转移研究的新范式,通过直接分析患者源性LECs,为理解肿瘤-微环境互作提供了更贴近临床的真实模型。随着后续研究的深入,这些发现有望转化为预测淋巴转移的分子诊断工具和针对特定通路的新型靶向疗法,最终改善乳腺癌患者的预后。
 生物通微信公众号
生物通微信公众号
知名企业招聘