
-

生物通官微
陪你抓住生命科技
跳动的脉搏
靶向蜕膜巨噬细胞:早产防治新策略的分子机制与治疗前景
【字体: 大 中 小 】 时间:2025年06月18日 来源:TRENDS IN Molecular Medicine 12.8
编辑推荐:
本研究聚焦早产发生机制中蜕膜巨噬细胞(decidual macrophages)的关键作用,揭示其通过促炎极化(M1-like)、细胞因子分泌(IL-1β/IL-6/TNFα)及基质金属蛋白酶(MMPs)释放,驱动功能性孕酮撤退(functional progesterone withdrawal)和胎膜破裂。研究团队通过动物模型验证M2巨噬细胞输注、IL-1β拮抗剂(anakinra)等干预手段可延缓早产,为临床防治提供了新靶点。
人类分娩启动机制至今仍是生殖医学领域的重大科学难题,尤其早产作为5岁以下儿童死亡的首要原因,其防治策略亟待突破。传统观点认为孕酮(progesterone)是维持妊娠的关键激素,但令人困惑的是人类分娩时孕酮水平并未下降——这种现象被称为"功能性孕酮撤退"(functional progesterone withdrawal)。近年来,帝国理工学院的研究团队在《TRENDS IN Molecular Medicine》发表的研究指出,子宫蜕膜组织中的巨噬细胞可能是解开这一谜题的关键钥匙。
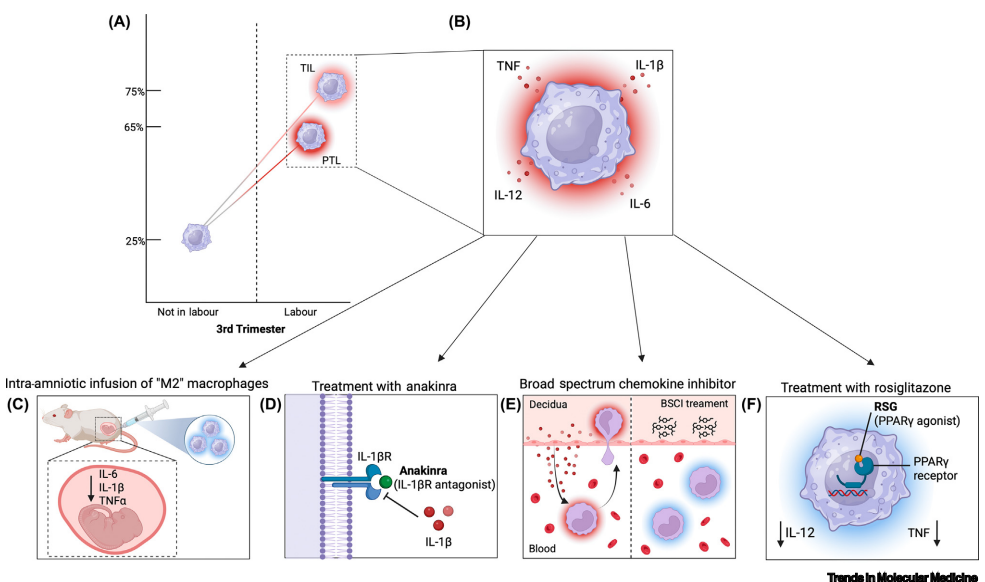
研究团队发现,妊娠晚期蜕膜中巨噬细胞数量激增,从非分娩状态的25%飙升至足月分娩时的75%。这些细胞并非静态存在,而是呈现动态演变:新招募的CCR2+
单核细胞分化为促炎性的CD11clow
HLA-DRlow
亚群,继而转化为具有组织驻留特征的CD11chigh
HLA-DRhigh
群体。这种转变伴随着NF-κB等炎症通路激活,促使IL-1β、TNFα等细胞因子风暴形成,直接削弱孕酮信号传导。更关键的是,这些巨噬细胞分泌的基质金属蛋白酶(MMPs)会降解胎膜弹性蛋白,为分娩创造"破膜"条件。
研究采用多维度技术体系:通过单细胞转录组揭示蜕膜巨噬细胞亚群特征;建立感染性和非感染性早产动物模型验证干预效果;利用离体实验验证广谱趋化因子抑制剂(BSCI)对单核细胞招募的阻断作用。
研究发现分娩时蜕膜炎症反应早于子宫肌层出现,巨噬细胞通过三重机制推动分娩:① 分泌IL-1β等细胞因子诱导功能性孕酮撤退;② 招募更多单核细胞形成炎症放大循环;③ 通过MMP-9破坏胎膜结构。在早产案例中,这种炎症反应更为剧烈,M1样表型巨噬细胞占比显著升高。
突破传统M1/M2二分法,研究鉴定出CD11chigh
和CD11clow
两个功能迥异的亚群。前者高表达组织驻留标志物TREM2/CD163,后者则具有更强的单核细胞招募能力。轨迹分析显示这两个亚群存在分化关联,构成动态平衡的微环境调控网络。
在动物模型中,M2巨噬细胞输注使早产率下降60%,其机制是通过抑制IL-6等炎症因子。临床常用药物罗格列酮(rosiglitazone)作为PPARγ激动剂,可促使巨噬细胞向M2表型转化,在感染性早产模型中显示出显著保护效应。
这项研究不仅阐明了蜕膜巨噬细胞作为分娩"启动开关"的分子机制,更开创性地提出四种靶向干预策略:细胞疗法(M2输注)、细胞因子阻断(anakinra)、单核细胞招募抑制(BSCI)和表型调控(PPARγ激动剂)。这些发现为早产防治提供了精准医学新思路,未来可通过监测蜕膜巨噬细胞亚群变化预测分娩风险,实现早产的早期干预和个性化治疗。
 生物通微信公众号
生物通微信公众号
知名企业招聘