
-

生物通官微
陪你抓住生命科技
跳动的脉搏
综述:基于肠道微生物的肠道相关疾病治疗策略的共同机制:基于与肠道屏障的多靶点相互作用
【字体: 大 中 小 】 时间:2025年06月19日 来源:Cell Communication and Signaling 8.2
编辑推荐:
这篇综述系统阐述了肠道屏障(intestinal barrier)功能在溃疡性结肠炎(UC)、结直肠癌(CRC)和2型糖尿病(T2DM)等肠道相关疾病中的核心调控作用,揭示了肠道菌群失调通过破坏生物屏障(SCFAs、BAs等代谢物减少)、机械屏障(ZO-1/Occludin表达下调)、化学屏障(MUC2分泌减少)及免疫屏障(Th17/Treg失衡)的共同病理机制,并提出益生菌(Bifidobacterium/Lactobacillus)、后生元(SCFAs)、粪菌移植(FMT)和小檗碱(BBR)等多靶点干预策略,为开发广谱肠道疾病治疗药物提供了新方向。
肠道作为消化吸收的核心器官,同时是内分泌、能量代谢和免疫调控的枢纽。肠道屏障由四层防御体系构成:生物屏障(肠道菌群及其代谢产物)、机械屏障(肠上皮细胞IECs及紧密连接TJ)、化学屏障(杯状细胞分泌的MUC2黏液层和潘氏细胞的抗菌肽AMPs)以及免疫屏障(巨噬细胞、T淋巴细胞等)。这些屏障通过动态交互维持肠道稳态,选择性吸收营养物质(如SCFAs、BAs)的同时抵御病原体入侵。

肠道菌群代谢产生的短链脂肪酸(SCFAs,如乙酸、丙酸、丁酸)通过激活GPR41/43/109a受体,调控肝脏PPARα/AMPK通路抑制脂肪生成,促进白色脂肪组织棕色化(UCP-1↑)。作为HDAC抑制剂,SCFAs通过表观遗传修饰促进Treg细胞分化(Foxp3↑),抑制Th17炎症反应(IL-17↓)。次级胆汁酸(如LCA、DCA)通过FXR/TGR5受体增强GLP-1分泌,而色氨酸代谢产物吲哚通过AhR通路抑制肝脏NF-κB炎症信号。
肠上皮干细胞(Lgr5+
ISCs)分化的IECs通过ZO-1/2/3、Claudin等TJ蛋白构成机械屏障,其完整性受AMPK/HIF-1α调控。丁酸作为结肠上皮主要能量源,可上调TJ蛋白表达;牛磺酸结合型胆汁酸通过EGFR/ERK通路促进IECs增殖。杯状细胞分泌的MUC2形成化学屏障,其缺陷(如FUT8过表达导致MUC2/MUC5失衡)与UC发病直接相关。
肠道免疫屏障由M1/M2巨噬细胞、Th17/Treg、ILC3等细胞构成。SCFAs通过促进M2极化(IL-10↑)和OXPHOS代谢重编程抑制炎症;IL-22分泌型ILC3通过Wnt/β-catenin通路增强IECs再生。而屏障损伤时,M1巨噬细胞(TNF-α/IL-6↑)和Th17(IL-17↑)过度激活会加剧UC和T2DM的慢性炎症,CRC中则表现为CD8+
T细胞减少和Treg免疫抑制微环境形成。
UC、CRC和T2DM患者均显示有益菌(Bifidobacterium、Roseburia)减少和有害菌(Escherichia coli)增多,伴随SCFAs水平下降、TJ蛋白(ZO-1↓)和MUC2表达降低。免疫屏障方面,三者的差异在于:UC表现为ILC3/B细胞增多,CRC和T2DM则呈现ILC3减少及免疫抑制状态。
临床研究显示:
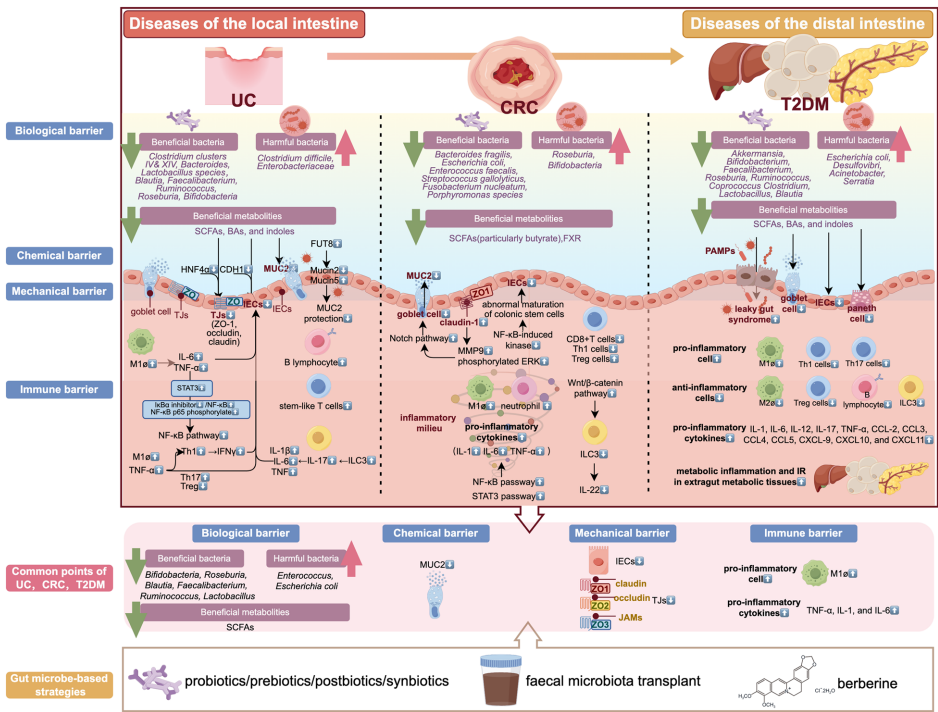
靶向肠道菌群-屏障轴的干预策略为多重肠道疾病治疗提供新思路,但需进一步明确FMT的长期安全性及个体化菌群调控方案。通过整合微生物组学与多组学技术,开发基于SCFAs/BAs受体的精准疗法将成为未来研究方向。
 生物通微信公众号
生物通微信公众号
知名企业招聘